Системы контролируемой экспрессии генов позволяют ученым доставить в модельную клетку интересующий их ген, а затем включать и выключать его экспрессию по своему усмотрению. Одно из основных применений этих систем — исследование функций белков. Ученые из МГУ им. М. В. Ломоносова создали многообещающую систему контролируемой экспрессии, использующую белок Cre бактериофага P1. Новая система обладает важным качеством — низкой «фоновой» экспрессией таргетного гена, когда система не активирована, и его высокой экспрессией, когда система активирована.
Не все белки нужны клетке постоянно и в одном и том же количестве. Основную роль в регуляции экспрессии генов (синтеза закодированных в генах молекул) играют участки ДНК, располагающиеся перед генами, — промоторы и энхансеры. Чтобы с гена считывалась матричная РНК — то есть, происходила его транскрипция, — перед ним должен собраться специальный белковый комплекс инициации транскрипции. Сборку этого комплекса начинают особые белки-транскрипционные факторы, которые связываются с промоторами и энхансерами и привлекают остальные компоненты комплекса. Транскрипционные факторы имеют ДНК-связывающий домен, позволяющий им узнавать определенные последовательности нуклеотидов в промоторах, и активаторный домен, привлекающий необходимые для транскрипции белки (как это все работает, можно посмотреть в этом видео). Транскрипционные факторы могут быть более универсальными или более специфичными к конкретным промоторам.
Благодаря развитию генной инженерии ученые теперь могут вводить интересующие их гены в клеточные культуры и модельные организмы и регулировать экспрессию этих генов, добавляя молекулы-активаторы.
Контролируемая экспрессия целевых генов — мощный инструмент для изучения их функций. Например, с его помощью удалось разобраться, какие гены отвечают за различия формы листьев у двух близких видов растений (M. Barkoulas et al., 2008. A developmental framework for dissected leaf formation in the Arabidopsis relative Cardamine hirsuta). Также с помощью контролируемой экспрессии генов можно изучать последствия мутаций в этих генах.Минимальный «набор» для контролируемой экспрессии чужеродного гена должен содержать исследуемый ген, сшитый с определенным промоторным участком, и активатор экспрессии, узнающий этот промотор.
Существует множество искусственных систем для контролируемой экспрессии генов, и создавать их помогает сама природа. Например, одна из наиболее часто применяющихся систем использует в качестве активатора антибиотик тетрациклин и была подсмотрена у бактерий (A. T. Das et al., 2016. Tet-On Systems For Doxycycline-inducible Gene Expression). Дело в том, что у некоторых штаммов кишечной палочки Escherichia coli есть ген белка tetA, обеспечивающего бактерии устойчивость к тетрациклину. Но в отсутствие антибиотика этот белок вреден: во-первых, на его синтез уходят ресурсы, во-вторых, он обладает побочными эффектами для жизнедеятельности бактериальной клетки. Поэтому по умолчанию на промоторе гена устойчивости сидит белок-репрессор, препятствующий сборке РНК-полимеразного комплекса (см. Tet Repressor proteins). Но тетрациклин, попав в клетку, связывается с белком-репрессором, что приводит к его отсоединению от промотoра и, тем самым, к активации транскрипции гена устойчивости (см. Tetracycline-controlled transcriptional activation).

Не только бактерии вдохновляют авторов систем контролируемой экспрессии. Например, есть система, основанная на использовании растительного белка фитохрома B в паре с транскрипционным фактором PIF6 (phytochrome-interacting factor 6). Запускает экспрессию красный свет (длина волны 660 нм), а выключает — дальний красный (740 нм). Фитохромы — белки растений, меняющие свою конформацию под действием света с разной длиной волны: красный свет активирует белок, дальний красный переводит его в неактивное состояние. Фитохромы и другие фоторецепторные белки помогают растениям «видеть», что происходит вокруг, и реагировать на изменение освещенности, например, из-за затенения другими растениями (Y. Zhang et al., 2020. Central clock components modulate plant shade avoidance by directly repressing transcriptional activation activity of PIF proteins). В разработанной учеными системе фитохром B под воздействием красного света активируется и связывается с PIF6, к которому пришит домен, позволяющий ему узнавать промотор, поставленный перед целевым геном, и, тем самым, активировать экспрессию этого гена (K. Müller et al., 2013. A red/far-red light-responsive bi-stable toggle switch to control gene expression in mammalian cells).
Конечно, идеального варианта нет, и все системы контролируемой экспрессии в той или иной степени обладают следующими недостатками:
1) неспецифическая активация нецелевых генов, приводящая к нежелательным воздействиям на жизнедеятельность клеток;
2) ненулевая экспрессия целевого гена в отсутствии активатора (эту проблему называют «подтеканием» промотора);
3) неэффективная доставка активаторов в клетку (например, в случае их больших размеров).
Кроме того, разные системы показывают разную эффективность в разных условиях. Поэтому новые системы контролируемой экспрессии продолжают создаваться, а старые — совершенствоваться. Недавно в журнале Cells была опубликована статья, в которой сотрудники Факультета фундаментальной медицины МГУ представили новый вариант такой системы.
Работа началась с поиска сравнительно коротких ДНК-связывающих белков с высокой специфичностью, не имеющих участков связывания в геномах человека и мыши (это важно для предотвращения побочной активации генов при использовании будущей системы в культурах человеческих клеток и в мышиных моделях). Выбор исследователей пал на Cre-рекомбиназу (Cre recombinase) бактериофага P1.
P1 — умеренный бактериофаг. Так называют вирусы бактерий, способные к лизогении. Во время лизогенной стадии P1 существует в бактериальной клетке в виде кольцевой молекулы ДНК — плазмиды. Вирусный геном при этом реплицируется, и при делении бактерии ДНК вируса попадает в обе дочерние клетки. При изменении условий вирус может перейти в литическую стадию: в бактериальной клетке образуется множество вирусных частиц, после чего клетка лизируется (разрушается), выпуская вирусное потомство. Вирион (вирусная частица) фага P1 представляет собой икосаэдрическую головку, снабженную сокращающимся хвостом с шестью ножками для посадки вируса на бактериальную клетку (внешне он напоминает бактериофаг Т4). ДНК вируса находится в головке и впрыскивается в клетку при сокращении хвоста. В геноме фага P1 найдено 119 генов (M. F. Gonzales et al., 2022. New Insights into the Structure and Assembly of Bacteriophage P1). Для сравнения: у вируса гриппа А генов всего 8. Внутри вириона ДНК линейная, но при попадании в клетку она замыкается и становится кольцевой. Циркуляризация вирусного генома — работа белка Cre. Сшивание концов ДНК происходит за счет рекомбинации. Белок поэтому и называется Cre — от causing recombination.
Генетическая рекомбинация — разрезание и сшивание молекул ДНК, приводящее к перестановке их участков. В результате рекомбинации может произойти транслокация (участки ДНК меняются местами), инверсия (участок ДНК переворачивается) или делеция (участок ДНК вырезается). Cre-рекомбиназа узнает определенную последовательность нуклеотидов, которая получила название loxP. Чтобы произошла рекомбинация, две молекулы Cre, связавшиеся с одним сайтом loxP, должны встретиться с двумя другими молекулами Cre, связанными с другим сайтом loxP. Это приведет к разрезанию сайтов loxP посередине и обмену получившимися концами.
Cre-рекомбиназа более 30 лет используется в молекулярной биологии. Однако, авторам обсуждаемой статьи было важно использовать специфичность ее связывания с ДНК, а не рекомбиназную активность. Поэтому каталитическая активность белка была устранена введением в ген cre специальных мутаций. Чтобы взамен придать белку Cre функцию транскрипционного фактора, к гену пришили последовательность, кодирующую активаторный домен белка VP16 (для надежности — даже не одну последовательность, а четыре).
VP16 — транскрипционный фактор альфагерпесвирусов, известным представителем которых является вирус простого герпеса. Этот белок попадает в клетку в составе вириона и проникает в ядро вместе с вирусной ДНК. Там он привлекает некоторые клеточные белки, и образующийся комплекс активирует транскрипцию генов на вирусной ДНК. VP16 — очень сильный активатор транскрипции, поэтому его часто используют в генной инженерии (H. Hirai et al., 2012. Structure and functions of powerful transactivators: VP16, MyoD and FoxA).
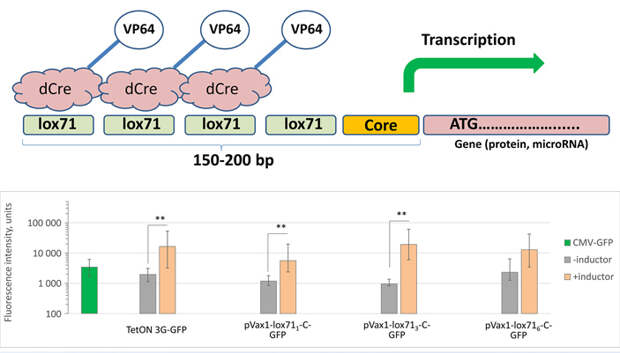
Испытав разные варианты, авторы статьи получили следующую оптимальную конструкцию: промотор — последовательность из трех сайтов lox71 (аналог loxP с небольшими модификациями) в сочетании с дополнительными регуляторными участками, необходимыми для эффективной транскрипции, и активатор — каталитически неактивная Cre-рекомбиназа, сшитая с последовательностью из четырех активаторных доменов VP16, называемой VP64. Ученые показали, что система имеет низкую базальную активность и высокую эффективность (то есть ген практически не читается с промотора в отсутствие активатора, но при этом транскрипция бодро идет при его добавлении). Базальная активность системы оказалась ниже, а эффективность — выше, чем у системы, основанной на тетрациклине.
Для работы системы контролируемой экспрессии нужно доставить в ядро клетки плазмиду с интересующим геном и стоящим перед ним сконструированным промотором, а затем активировать транскрипцию этого гена, добавив активатор. Пока авторам новой системы удалось транспортировать активатор только в виде плазмид — то есть в клетки попадает не сам активатор, а его ген. Ученые планируют также разработать схему, при которой в клетку для активации промотора будет доставляться готовый белок. Это должно позволить более точно регулировать активацию транскрипции.
Источник: Maxim Karagyaur, Daniyar Dyikanov, Pyotr Tyurin-Kuzmin, Stalik Dzhauari, Mariya Skryabina, Maksim Vigovskiy, Alexandra Primak, Natalia Kalinina, Vsevolod Tkachuk. A Novel Cre/lox71-Based System for Inducible Expression of Recombinant Proteins and Genome Editing // Cells. 2022. DOI: 10.3390/cells11142141.
Галина Клинк

Свежие комментарии