Исследователи из Вашингтонского университета и их коллеги обнаружили и описали дополнительный путь оттока спинномозговой жидкости, позволяющий макромолекулам головного мозга выводиться без необходимости пересечения ткани головного мозга – через артериально-венозные точки перекрытия в мягкой и паутинной оболочках. Этот механизм можно считать важным дополнением существующих представлений работы глимфатической системы и механизмов очищения головного мозга. Результаты исследования опубликованы в журнале Nature Neuroscience.
Найденные артериовенозные шунты. Credit: Plog, B.A. et al. / Nature Neuroscience 2025
Мозг, как и любой орган, в процессе жизнедеятельности неизбежно производит «отходы» — различные продукты метаболизма, поврежденные белки и другие молекулы, которые необходимо удалять. Один из наиболее известных негативных примеров задержки подобных отходов – накапление бета-амилоида, который в результате образует токсичные бляшки и приводит к развитию болезни Альцгеймера.
До недавнего времени считалось, что основную роль в очистке играет глимфатическая система – сеть каналов вдоль сосудов, по которым спинномозговая жидкость (СМЖ, или, иначе говоря, ликвор) вымывает отходы через паренхиму (ткань) мозга. Однако глимфатический путь эффективен только для мелких молекул, а крупные типа альбумина не могут через него проходить. Кроме того, при некоторых состояниях (отек мозга или гидроцефалия), объем СМЖ резко увеличивается, и традиционные пути очистки могут не справляться. Именно поэтому поиски альтернативных механизмов остаются важной областью в понимании работы мозга.
Исследование, проведенное в Центре иммунологии Мозга и Глии (BIG) Вашингтонского университета в Сент-Луисе, выявило новый механизм циркуляции и дренажа ликвора в головном мозге. Авторы обнаружили ранее неизвестный альтернативный путь оттока СМЖ, позволяющий крупным молекулам перемещаться непосредственно между артериальными и венозными пространствами мозговых оболочек. Как выяснилось, этот анатомический путь прямого обмена жидкостями между сосудистыми пространствами вокруг артерий и вен ведет к очищению мозга от излишков крупных белков.
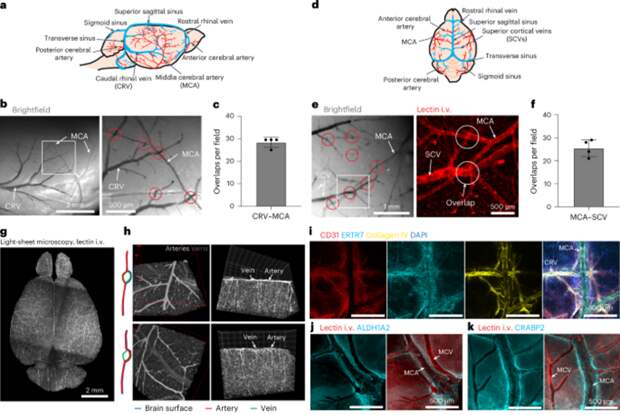
Чтобы изучить этот вопрос, авторы статьи – один из которых Джонатан Кипнис, ранее открывший менингеальные лимфатические сосуды – провели эксперименты на 4-х и 12-недельных мышах. Они использовали метод интрацеребральных инъекций флуоресцентных маркеров для отслеживания движения цереброспинальной жидкости.
Ученые вводили в спинномозговую жидкость флуоресцентные метки (гранулы диаметром 0,5 мкм), а также меченый овальбумин, и отслеживали их движение. При этом за движением маркеров следили в реальном времени с помощью стереомикроскопии – это возможно благодаря полупрозрачной структуре костей черепа молодых мышей.
Благодаря световой и конфокальной микроскопии, нужных для того чтобы проанализировать распределения флуоресцентных веществ в различных областях головного мозга, ученым удалось получить трехмерные реконструкции, которые демонстрировали движение частиц от артериальных пространств к венозным.
После завершения экспериментов с живыми мышами их мозг извлекался и исследовался с помощью конфокальной микроскопии. В результате авторы объединили сверхчеткие снимки на разной глубине ткани, что позволило точно определить расположение флуоресцентных маркеров в периваскулярных (околососудистых) пространствах, измерить размеры этих каналов вокруг артерий и вен, а также убедиться, что маркеры в действительности прошли через зоны перекрытия сосудов, а не диффундировали случайным образом.
Все эти методы визуализации в совокупности убедительно продемонстрировали, что СМЖ и крупные молекулы могут переходить из периартериальных в перивенозные пространства, минуя паренхиму. Кроме того, с помощью электронной микроскопии даже удалось показать саму структуру каналов, по которым проходит СМЖ.
Но на этом исследователи не остановились и пошли дальше: они также проверили свое открытие на человеческом мозге. Исследуя образцы мозговых оболочек тех людей, кто после смерти пожертвовал свой мозг для науки, они обнаружили те же самые артериовенозные перекрытия, что и у мышей. Это подтвердило существование и работу открытого механизма у людей.
И в здравии, и в болезни
Для того, чтобы узнать, как система лептоменингеального артериовенозного шунтирования функционирует при болезнях, исследователи разработали несколько патологических моделей.
Они моделировали повышенный объем ликвора для изучения тех изменений, которые присутствуют при гидроцефалии. Шунтирование частиц в этом случае оказалось более активным в перивенозном пространстве. То есть при увеличении объема СМЖ путь через артериовенозные перекрытия усиливается, помогая отводить избыток жидкости. Однако при отеке мозга шунтирование, наоборот, нарушается, что усугубляет повреждение.
То, как мозг очищается от бета-амилоида, изучали с помощью введения овальбуминов (ОВ) и мониторинга их распространения. Оказалось, что прямой путь между периартериальными и перивенозными пространствами работает даже при наличии амилоидных отложений.
Обнаруженный механизм артериовенозного шунтирования в лептоменингеальных оболочках наглядно демонстрирует что система «утилизации отходов» из мозга функционирует сложнее, чем ранее полагали. Открытие улучшает понимание физиологии головного мозга и механизмов развития заболеваний нервной системы – например, гидроцефалии, инсульта, болезни Альцгеймера и других. Также открытие предлагает и новые терапевтические цели для борьбы с этими заболеваниями.
Хотя многие вопросы еще предстоит изучить, исследователи уже заложили прочную основу для будущих работ и открытий в этой области.
Текст: Анастасия Буглинина, Анастасия Амерханова
A route for cerebrospinal fluid flow through leptomeningeal arterial—venous overlaps enables macromolecule and fluid shunting by Plog, B.A. et al. in Nature Neuroscience. 2025 https://doi.org/10.1038/s41593-025-01977-4
Свежие комментарии