У 57-летнего Дэвида Беннетта (рис. 1) из США было тяжелое заболевание сердца, но из-за нерегулярного сердцебиения и нарушения предписания врачей он не мог получить ни механическое сердце, ни донорское.
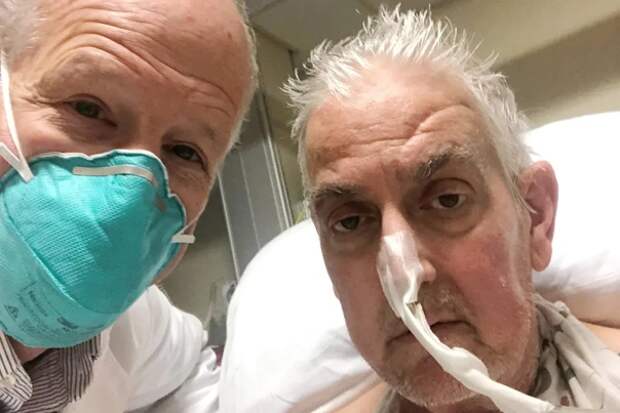
Рис. 1. Дэвид Беннетт (справа). Источник: https://static.standard.co.uk/2022/01/11/07/newFile. jpg?width=1200&width=1200&auto=webp&quality=75
Учитывая, что в противном случае пациенту грозила верная смерть, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) дало разрешение на экспериментальную операцию: пересадку Беннетту сердца, донором которого выступила генетически модифицированная свинья.
Восьмичасовая операция (рис. 2) была успешно проведена 7 января 2022 года в медицинском центре университета штата Мэриленд в городе Балтимор, и до последнего времени пациент проходил восстановление. Что пошло не так и почему первый реципиент свиного сердца скончался, не сообщается. Однако сам факт проведения ксеногенной трансплантации уже вселил во многих людей, годами ждущих своей очереди на донорский орган, большие надежды.
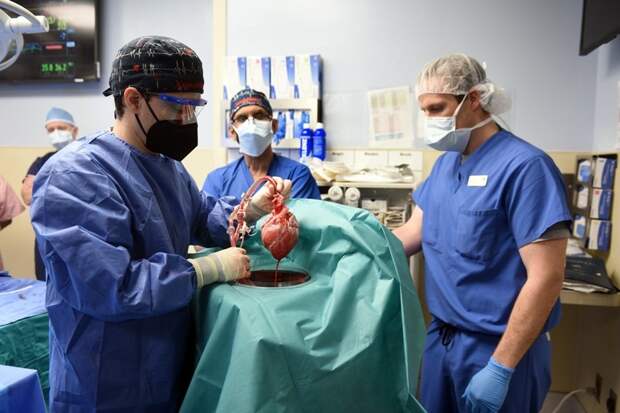
Рис. 2. Сердце ГМ-свиньи. Источник: https://media.nature.com/lw800/magazine-assets/d41586-022-00111-9/d41586-022-00111-9_20031760.jpg
До этого на людях удавалось проводить только аллогенные трансплантации, когда пересаживаются органы от человека-донора к человеку-реципиенту, а также аутологичные, когда материал забирают у самого пациента и ему же пересаживают. Однако на протяжении истории предпринимались и многочисленные попытки пересадить органы животных в организм человека.
Если опустить противоречивые данные о попытках переливания крови некоторых млекопитающих человеку, а также другие немыслимые процедуры, которые пытались проводить в XVIII-XIX веках, то серьезно о ксенотрансплантации можно говорить, начиная со второй половины XX века.
В 1960-х гг. Кит Реемтсма (рис. 3) с коллегами в Тулейнском университете (Луизиана, США) предположили, что почки приматов могут быть использованы в лечении почечной недостаточности людей. Врачи пересадили органы шимпанзе умирающим пациентам-людям: один из них выжил и прожил в течение 9 месяцев, даже вернувшись к работе учителем, прежде чем его тело окончательно отторгло орган.

Рис. 3. Кит Реемтсма (1925–2000). Источник: https://i0.wp.com/mp.reaviz.info/wp-content/uploads/2019/03/reemtsma.jpg?resize=409%2C560
Вдохновленные работами Кита Реемтсма в 1984 году группа хирургов под руководством Леонарда Бейли (рис. 4) в Калифорнии пересадила сердце бабуина в тело маленькой девочки, которая страдала синдромом гипоплазии левых отделов сердца. Девочка прожила всего 21 день после процедуры. Ксенотрансплантат должен был быть временным, но, к сожалению, подходящий донорский орган не нашли. В историю эта операция вошла как «случай Baby Fay».

Рис. 4. Леонард Бейли (1942–2019). Источник: https://www.lstream.org/wp-content/uploads/26716934257_6493eb7b2b_z.jpg
Операцию по пересадке печени от обезьян двум пациентам в 1992 году удалось выполнить отцу современной трансплантологии Томасу Старзлу (рис. 5) в клинике Питсбургского медицинского центра (США). Один из двух реципиентов выжил и прожил 70 дней после этой операции. Но такие "успехи", конечно, не могли служить оправданием продолжения исследований.
Рис. 5. Томас Старзл (1926–2017). Источник: https://indicator.ru/thumb/475x0/filters:quality(75)/imgs/2019/08/05/10/3499861/a502fef03338fa1a3a1679a42c4624f0dc6c20f7.jpg
Неудачные операции позволили понять, что приматы – плохие доноры органов. Ксеноорганы обезьян, как и других животных отторгаются, к тому же всегда существуют опасения, что реципиенту-человеку от обезьян могут передаться инфекционные заболевания – ксенозоонозы – те же ретровирусные или филовирусные инфекции. Да и выращивать приматов на органы нелегко, тем более, что многие из них были внесены в список исчезающих видов. Можно сказать, что ученые начали отказываться от идеи конкордантной ксенотрансплантация органов – то есть пересадки между филогенетически близкими видами, такими, например, как мышь и крыса, и стали всерьез говорить о дискордантной ксенотрансплантации – пересадке органов между неродственными видами.
В рамках данной идеи нашлось животное, которое давно разводится в промышленных масштабах и имеет органы, наиболее совместимые с органами человека. Это – домашняя свинья. Исследователи уже давно приглядывались к свиным органам как к потенциальному решению проблемы продолжающейся нехватки доноров. Кроме того, значительное филогенетическое расстояние между свиньей и человеком снижает риск передачи вирусных инфекций. Интересно, однако, что до недавнего времени процедуры трансплантации с использованием органов свиней терпели неудачу.
В 2018 году несколько групп хирургов во главе с немецким кардиоторакальным хирургом Бруно Райхартом (рис. 6) успешно пересадили генетически модифицированные свиные сердца в тела бабуинов.

Рис. 6. Бруно Райхарт (р. 1943). Источник: https://upload.wikimedia.org/wikipedia/commons/9/92/Bruno_Reichart_%28TRR%29.jpg
Бабуины, которым заменили сердце трансгенными свиными органами, выживали до 195 дней после трансплантации благодаря тому, что Рейхарт и его коллеги использовали специальный протокол иммуносупрессии и оптимизированную процедуру ксенотрансплантации. В частности, в ГМ-сердцах свиней отсутствовали эпитопы сахара α-1,3-галактозы (α-Gal), который вместе с некоторыми другими углеводами ответственен за сверхострое отторжение ксеноорганов. Известно, что ген фермента α-1,3-галактозилтрансферазы (GGTA1), синтезирующего этот сахар, имеется у многих животных, но у человека и прочих приматов утрачен, поэтому α-1,3-галактоза воспринимается иммунной системой как антиген. Помимо этого, свиньям были добавлены гены человеческих белков CD46 и тромбомодулина, что позволило "исправить" несовместимость между человеческой и свиной системами свертывания крови.

Рис. 7. Свинья и бабуин. Источник: https://media.springernature.com/full/springer-static/image/art%3A10.1038%2Fs41569-018-0151-4/MediaObjects/41569_2018_151_Figa_HTML.png
Несмотря на успех пересадки органов свиней приматам (рис. 7), среди ученых сохранялся большой скепсис по поводу возможности их трансплантации от свиней человеку. Некоторые считали, что работа на приматах, имеющих свои особенности работы иммунной системы, была проделана зря, поскольку в результате получались органы, пригодные для трансплантации бабуинам, но никак не людям.
Однако в ноябре 2021 года произошел прорыв: хирурги из Нью-Йоркского университета Langone Health успешно пересадили почки от свиней с нокаутированным геном α-1,3-галактозилтрансферазы (α-1,3-galactosyltransferase gene-knockout pigs, или GTKO pigs) двум умершим людям. Органы не отторглись, и в течении 54 часов, пока тела находились на искусственном жизнеобеспечении, вырабатывали мочу и выполняли свои физиологические функции. Эта процедура стала первым случаем, когда весь орган, принадлежащий животному другого вида, пережил процесс трансплантации и функционировал естественным образом в теле человека.
На каком уровне ксенотрансплантация находится прямо сейчас вы уже знаете: это пересадка сердца Дэвиду Беннетту. Но мы не ответили на вопрос, как вообще операции, которые вчера казались рискованными и даже сумасбродными, сегодня стали реальностью?
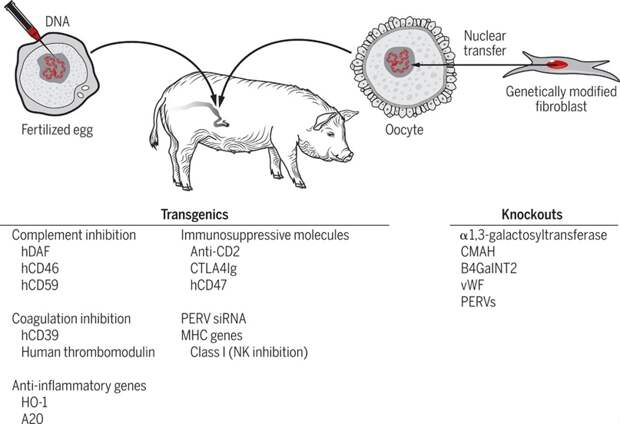
Рис. 8. Генетические модификации, которые используют для упрощения ксенотрансплантации от свиньи к человеку. Источник: https://www.science.org/cms/10.1126/sciimmunol.aau6298/asset/78f24a42-b3e3-4612-834f-670867ca29d1/assets/graphic/aau6298-f3.jpeg
Если говорить коротко, то это стало возможным во многом благодаря новым генетическим технологиям, а именно CRISPR-Cas, которая позволила упростить создание ГМ-животных (рис. 8). В частности, сердце, пересаженное Беннетту, было изъято у гуманизованной свиньи с 10 отредактированными генами. А именно 3 свиных гена было нокаутировано для снижения иммуногенности тканей (сверхострого отторжения). Это гены ферментов, синтезирующих поверхностные сахара, отсутствующие у человека и в случае пересадки, сразу распознаваемые человеческими антителами. 6 генов было, наоборот, добавлено в геном свиньи для повышения приживаемости органа. Для этого традиционно используют гены ингибирования системы комплемента, например, CD46, CD55, CD59, а также ген, кодирующий CD47-лиганд, необходимый для предотвращения фагоцитоза нормальных эритроцитов. Еще одна модификация служила для отключения восприимчивости клеток к ростовым гормонам и, тем самым, поддержания сердца 400-килограммовых животных размером с человеческий орган.
Как говорят ученые, хотя комбинация из 10 генов, похоже, сработала, однако остается много неясного. Для оценки каждой генетической модификации требуется гораздо больше научных данных, потому что какие-то из них могут оказаться потенциально вредными для людей.
Но пока, в любом случае, речь о массовом внедрении ксенотрансплантации не идет: как заявляет Дэвид Айарес из компании Revivicor, который уже два десятилетия занимается созданием ГМ-свиней, «производство» каждой ГМ-свиньи стоит слишком дорого.
Свежие комментарии