
Распознавание своего и чужого — один из важнейших принципов функционирования иммунной системы. Благодаря ему наш организм узнает и уничтожает патогены, не трогая собственные клетки и ткани. К распознаванию своего и чужого способны даже эволюционно примитивные представители животного царства, такие как гидроидные полипы. Американские ученые исследовали генный локус гидрактинии Hydractinia symbiolongicarpus, на котором расположены два известных гена, участвующих в работе системы распознавания. Оказалось, что в этом локусе находятся несколько десятков генов, которые кодируют иммуноглобулиноподобные белки и, вероятно, имеют сходные с этими двумя генами функции. Эта работа показывает, что даже у примитивных многоклеточных иммунная система устроена чрезвычайно сложно.
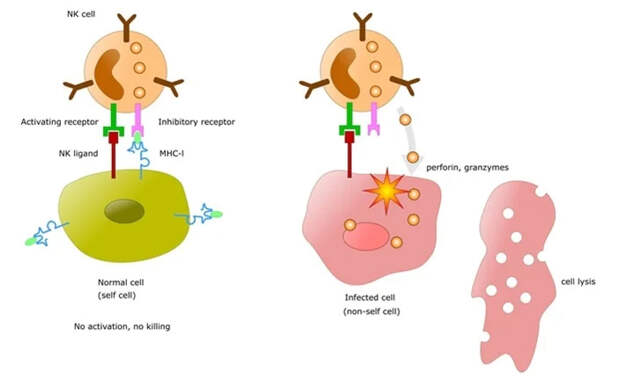
Обычно считается, что основная работа иммунной системы — защита организма от инфекций. Но на это можно посмотреть несколько шире: защита от паразитов и патогенов — частный случай общей задачи распознавания «чужого» и «своего», лежащей в основе иммунитета. Клетки иммунной системы считывают молекулярные сигналы на поверхности клеток, которые попадаются им в организме, и выявляют среди них откровенно чужеродные элементы вроде паразитов, патогенных бактерий и грибков, а также инфицированных вирусами или ставших злокачественными клеток самого организма. После распознавания чужого следует бескомпромиссный ответ: оно должно быть умерщвлено и отторгнуто. Такая принципиальность иммунной системы остро необходима для защиты от инфекций. Однако она обращается во вред, когда дело доходит, например, до трансплантации органов.
Подсадку органа от генетически неидентичного человека иммунная система воспринимает как вторжение чего-то чужеродного, и для того, чтобы пересаженный орган прижился, приходится принимать специальные меры по укрощению боевого пыла иммунитета. При аутоиммунных заболеваниях иммунная система ошибочно атакует собственные клетки и ткани и нередко развивает ответ такой силы, словно столкнулась с тяжелой инфекцией. Каким образом же иммунная система отличает свое от чужого?Все клетки нашего тела, за исключением эритроцитов, несут на своей поверхности «молекулярный паспорт» — особый белковый комплекс, кодируемый генами главного комплекса гистосовместимости (main histocompatibility complex, MHC) I класса. Основное предназначение белков MHC I класса — представление на поверхности клетки фрагментов продуктов генов, которые экспрессируются в ней. С помощью молекул MHC клетка сообщает иммунным клеткам, патрулирующим организм, что она — обычная законопослушная клетка, внутри которой нет никаких чужеродных белков, и ее убивать не надо (рис. 2). Аминокислотные последовательности компонентов MHC отличаются колоссальным разнообразием, поэтому найти неродственных людей с близкими MHC — нетривиальная задача. Когда происходит аллотрансплантация органа, то есть пересадка от донора со значительно отличающимся MHC, то в организме реципиента оказывается множество клеток с другим MHC. Иммунная система распознает эти молекулы MHC как чужеродные и потенциально опасные, а потому приступает к отторжению несущих чужие MHC клеток и тканей.
Многие морские беспозвоночные живут колониями, которые могут время от времени сливаться друг с другом (рис. 3). Но порой слияния не происходит, и, несмотря на первоначальный контакт двух колоний, связь между ними разрывается (рис. 1). Ученые говорят, что в этом случае происходит аллораспознавание (см. Allorecognition) — две генетически сильно различающиеся колонии поняли после первичного контакта, что сливаться им все же не стоит, и отторгли друг друга. Если бы аллораспознавания не было и генетические неродственные колонии беспрепятственно сливались, то был бы велик риск, что одна из колоний начала бы паразитировать на другой. Кормить родственника колонии не против, а вот в обеспечении всем необходимым чужеродного нахлебника они совершенно не заинтересованы.

Аллораспознавание у колониальных беспозвоночных напомнил вам распознавание своего и чужого при трансплантации у позвоночных, не так ли? Иммунологи, конечно, тоже подметили это сходство, но ответить на вопрос, отвечают ли за распознавание своего и чужого у низших беспозвоночных те же механизмы, что и у позвоночных, долгое время не получалось. Авторы недавнего исследования, опубликованного в журнале PNAS, выяснили, что у беспозвоночных действительно есть белки, близкие к белкам аллораспознавания позвоночных, которые отвечают за распознавание своего и чужого, однако пока нельзя говорить однозначно, является ли это сходство результатом общности происхождения или же оно возникло как следствие конвергентной эволюции.
Разные исследовательские группы изучали аллораспознавание у беспозвоночных на примере губки Amphimedon queenslandica, первичнохордового Botryllus schlosseri и гидроидного полипа Hydractinia symbiolongicarpus. Предыдущие исследования показали, что за распознавание своего и чужого у гидрактинии отвечает локус ARC (от allorecognition complex), в котором присутствуют два гена Alr1 и Alr2. Продукты генов Alr1 и Alr2 — трансмембранные белки, внеклеточные части которых отличаются высокой вариабельностью. Именно посредством взаимодействия внеклеточных частей этих белков клетки опознают свое и чужое, ведь взаимодействовать могут лишь те молекулы белков Alr1 или Alr2, которые близки по аминокислотной последовательности. В природе существуют десятки и сотни аллелей для каждого из этих генов, однако у лабораторных штаммов гидрактинии оба гена могут быть представлены лишь одним из двух аллелей. Благодаря этому система для изучения аллораспознавания становится очень простой: колонии гидрактинии, у которых нет ни одного общего аллеля в этих двух генах, не сливаются, и всего одного общего аллеля достаточно, чтобы две колонии могли соединиться в одну.
Есть ли у генов Alr1 и Alr2 родственники в животном царстве? Гомологичны ли они каким-то другим генам? Гомологами в биоинформатике называют нуклеотидные и аминокислотные последовательности, которое имеют общее эволюционное происхождение. В то время, когда эти гены были только описаны, никаких биоинформатических инструментов, которые позволили бы провести поиск гомологов, еще не существовало. Впоследствии, когда появился BLAST, — мощный инструмент, позволяющий выполнить поиск гомологов в базах данных для заданной нуклеотидной или аминокислотной последовательности, — ученые смогли установить, что внеклеточные участки белков Alr1 или Alr2 содержат несколько элементов, гомологичных иммуноглобулиновым доменам. Под доменами белка понимают подструктуры белковой молекулы, которые имеют характерную стабильную структуру и элементы аминокислотной последовательности и, как правило, предназначены для выполнения конкретной функции. В разных белках могут встречаться одни и те же домены, причем общность доменного состава белков является важным свидетельством в пользу общности их эволюционного происхождения. Иммуноглобулиновые домены входят в состав обширного списка белков, среди которых антитела и компоненты MHC. Кажется, вопрос решен — раз белки Alr1 и Alr2 имеют иммуноглобулиновый домен, то они родственны и MHC позвоночных? На самом деле, нет. Несмотря на некоторый уровень гомологии, сходство последовательностей между белками полипа и позвоночных оказалось довольно низким, более того, участки, близкие к иммуноглобулиновым доменам, у гидрактинии разделялись последовательностями, не похожими ни на какие известные белковые домены. Иными словами, хорошая зацепка была получена, однако однозначно утверждать наличие родства между белками распознавания своего и чужого у полипа и позвоночных пока еще было рано.
Впоследствии стало ясно, что ситуация с двумя генами Alr1 и Alr2 является большим упрощением. В дикой природе у гидрактинии только этих двух генов недостаточно для аллораспознавания. Более того, дальнейший анализ показал, что генов в локусе ARC существенно больше чем два. Вблизи гена Alr1 располагаются несколько Alr1-подобных последовательностей, а рядом с геном Alr2 были выявлены две копии Alr2, ставших псевдогенами — «поломанными» генами, утратившими исходную функциональность. Вполне возможно, что в локусе ARC есть еще немало копий генов Alr, но, чтобы их идентифицировать, нужно сначала отсеквенировать последовательность ARC гидрактинии. Авторы обсуждаемой работы так и поступили.
Локус ARC, как показало секвенирование, имеет длину не меньше 11,8 миллионов пар оснований. Поиск Alr-подобных генов, основанный на поиске последовательностей, похожих на гены Alr1 и Alr2, позволил идентифицировать 41 ген. Точнее, в предсказание кроме генов как таковых попали предполагаемые гены и псевдогены. К числу генов, в предсказании которых не было сомнений, было отнесено 18 генов, включая давно известные Alr1 и Alr2, — меньше половины от потенциального числа, но все равно немало. Согласно предсказаниям, выполненным по последовательностям генов, новооткрытые гены Alr кодируют трансмембранные белки, в состав которых входит как минимум один иммуноглобулиновый домен, подобный тем, что были выявлены в Alr1 и Alr2. К числу предполагаемых генов были отнесены гены, которые явно не входят в число псевдогенов, однако какие-то особенности не позволяли отнести их к «несомненным» генам, таковых нашлось 11. Наконец, двенадцать Alr-подобных генов были отнесены к псевдогенам. Система определения своего и чужого у гидроидного полипа оказалась куда более сложной, чем было принято считать.
С одного и того же гена иногда можно продуцировать белковые продукты с разной аминокислотной последовательностью, чаще всего это достигается при помощи альтернативного сплайсинга. Ранее были описаны некоторые варианты сплайсинга гена Alr1, а теперь ученым удалось охарактеризовать сплайсинговые изоформы и других генов Alr. Примечательно, что в некоторых случаях альтернативный сплайсинг вызывал изменение доменной архитектуры белкового продукта, общей для всех белков Alr! Например, у ряда сплайсинговых изоформ гена Alr6 и некоторых других генов Alr отсутствует трансмембранная спираль, которая удерживает белок в мембране, поэтому есть вероятность, что этот белок является секретируемым. В ряде случаев из-за альтернативного сплайсинга сильно меняются последовательности цитоплазматического и внеклеточного участков белка. Делать глубокие выводы из этих результатов, вероятно, пока рано, однако наличие сплайсинговых изоформ белков Alr с измененной доменной архитектурой идет в согласии со следующим результатом, который удалось получить, анализируя последовательности генов Alr.
Когда ученые анализируют последовательности предположительно родственных генов и белков, они почти всегда строят множественное выравнивание, смысл которого — совмещение совпадающих или схожих участков последовательностей с целью оценки их сходства. В последовательностях белков Alr прослеживается одна и та же консервативная доменная архитектура, поэтому ученые предположили, что все их разнообразие является результатом дупликации генов. Иными словами, предковый ген Alr в ходе эволюции удвоился, затем продукты этого удвоения подверглись дальнейшим дупликациям, и всякий раз общая архитектура белкового продукта на уровне кодирующей его последовательности гена сохранялась. Однако когда ученые попытались построить множественное выравнивание белков Alr, их ждало разочарование: выравнивание построить не удалось по причине слишком многочисленных различий между последовательностями. Вероятно, после ответвления от последовательности-предка гены Alr накопили так много мутаций, что алгоритм построения множественного выравнивания не смог уловить их сходство. По этой причине исследователям ничего не оставалось, как сравнивать последовательности белков Alr по двое, путем построения парных выравниваний. Оказалось, что средняя идентичность двух белков Alr составляет примерно от 15% до 33%, и лишь в двух попарных выравниваниях идентичность двух аминокислотных последовательностей Alr превысила порог 50% — не самый впечатляющий показатель для родственных белков. Остается лишь заключить, что эволюция белков семейства Alr сопровождалась активным изменением их последовательностей.
И все же, есть ли в белках Alr что-то, кроме иммуноглобулиновых доменов, что могло бы более явно указать на их родство или хотя бы конвергентное свойство с белками иммунной системы позвоночных? Анализ последовательностей цитоплазматических участков Alr, которые, к слову, оказались куда разнообразнее, чем внеклеточные участки, показал, что нередко в них содержатся элементы, обозначаемые как ITAM и ITIM. ITAM и ITIM — это небольшие аминокислотные последовательности, которые входят в состав рецепторов, активирующих (в случае ITAM) или ингибирующих (в случае ITIM) иммунный ответ у позвоночных, а также фагоцитоз поврежденных клеток у дрозофилы. Помимо множества других функций, ITAM и ITIM также задействованы и в распознавании своего и чужого. Более того, в геноме гидрактинии нашлись и гомологи генов, белковые продукты которых «проводят» активирующий или ингибирующий сигналы от ITAM или ITIM в клетке. Напрашивается вывод, что мотивы ITAM и ITIM в клетках гидрактинии функционируют примерно так же, как и у позвоночных, однако это предположение нуждается в экспериментальной проверке.
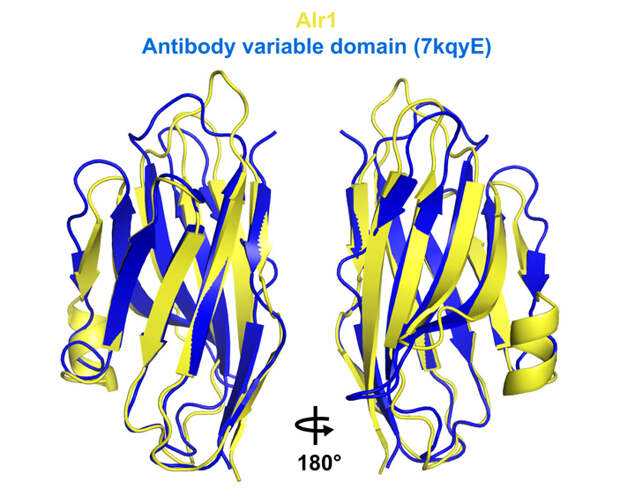
Наличие мотивов ITAM и ITIM в белках Alr гидрактинии, а также генов, кодирующих взаимодействующие с этими мотивами белки, конечно, указывает на некоторое сходство систем распознавания своего и чужого у гидрактинии и позвоночных на молекулярном уровне. Но что можно сказать про загадочные иммуноглобулиноподобные домены в белках Alr? Авторы первых исследований белков Alr1 и Alr2 отметили, что эти домены близки к доменам типа V-set из иммуноглобулинового семейства. Самый яркий пример домена V-set — вариабельный домен антитела, хотя такие домены есть и в других белках. Но близки ли к V-set иммуноглобулиноподобные домены других белков Alr? Для ответа на этот вопрос ученые сравнили аминокислотные последовательности этих доменов с последовательностями доменов V-set, которые хранятся в базе данных Pfam. Более того, они сравнили не только последовательности, но и третичные структуры доменов, которые были восстановлены по аминокислотной последовательности с помощью инструмента Colabfold — одной из модификаций алгоритма AlphaFold2. Для полученных с помощью Colabfold структур был проведен поиск близких структур из баз данных, который показал, что ближе всего к ним стоят домены V-set (рис. 4). И анализ последовательностей, и анализ структур однозначно свидетельствует, что белки Alr гидрактинии действительно имеют иммуноглобулиновые домены, входящие в группу V-set. Впрочем, более детальный их анализ позволил установить, что домены V-set имеют не все характерные последовательности-мотивы, которые служат диагностическими признаками доменов этой группы. Тем не менее, авторы обсуждаемого исследования стали первыми, кто получил последовательности доменов V-set организмов за пределами двусторонне-симметричных животных.
Однако у некоторых белков Alr есть еще два домена, которые тоже считают иммуноглобулиноподобными. Авторы работы проверили и уточнили это предположение с помощью поиска близких структур (как они поступили и с первым по очереди иммуноглобулиновым доменом, который, как уже говорилось, относится к числу V-set-доменов). Как выяснилось, оба предположительно иммуноглобулиновых домена действительно являются таковыми, причем относятся к группе I-set — в нее также входят домены, входящие в ряд белков, участвующих в межклеточной адгезии. Таким образом, в составе белков Alr можно найти три иммуноглобулиновых домена, первый из которых входит в группу V-set, а два других — в группу I-set (рис. 5).
И все же, возвращаясь к исходному посылу работы, что можно сказать о родстве систем распознавания своего и чужого у гидроидного полипа и позвоночных? Можно ли на основании высокого сходства иммуноглобулиновых доменов белков Arc с доменами семейств V-set и I-set делать вывод о наличии эволюционной связи? Свидетельствует ли в пользу общего происхождения тот факт, что очень похожие домены участвуют в распознавании своего и чужого у гидрактинии и позвоночных? К сожалению, на данный момент на этот вопрос нельзя ответить однозначно. Имеющиеся данные не позволяют доказать, что последовательности генов Alr ортологичны генам, участвующим в распознавании своего и чужого, даже у других беспозвоночных, не говоря уже о позвоночных. Да и гипотезу о конвергентной эволюции тоже не спишешь со счетов. В конце концов, функция различения своего и чужого в животном мире настолько важна, что реализуется даже у примитивных многоклеточных животных, лишенных настоящих тканей, и вполне возможно, что лежащие в ее основе биологические системы, близкие друг к другу по причине общности задач, появлялись в ходе эволюции несколько раз.
Таким образом, несмотря на то, что благодаря авторам работы наши знания об иммунитете низших животных и эволюции иммунной системы в целом значительно расширились, ответить на самый главный вопрос — родственна ли система различения своего и чужого у низших беспозвоночных таковой у человека — мы пока не можем. Будем надеяться, что исследование иммунной системы у других беспозвоночных поможет пролить свет на вопрос о возникновении и развитии древнейшей функции иммунитета — различении своего и чужого.
Источник: Aidan L. Huene, Steven M. Sanders, Zhiwei Ma, Anh-Dao Nguyen, Sergey Koren, Manuel H. Michaca, James C. Mullikin, Adam M. Phillippy, Christine E. Schnitzler, Andreas D. Baxevanis, and Matthew L. Nicotra. A family of unusual immunoglobulin superfamily genes in an invertebrate histocompatibility complex // PNAS. 2022. DOI: 10.1073/pnas.2207374119.
Елизавета Минина

Свежие комментарии