
Пандемия СOVID-19, которая началась в Ухане в конце 2019 года, стала вызовом для всего медицинского сообщества [1]. Новая коронавирусная инфекция носит мультисистемный характер и поражает не только легочную ткань, как изначально предполагалось, но и многие другие органы и ткани [2].
Заболевание является глобальной проблемой не только по причине высокой контагиозности и летальности (6,62 млн к ноябрю 2022 г.) [3], но и в связи с высокой частотой развития постковидного синдрома.Приобретенные за время пандемии эпидемиологические данные позволяют с уверенностью говорить о том, что ожирение является важнейшим фактором риска развития тяжелого течения COVID-19, критических состояний и смерти [4, 5]. У данной категории пациентов также чаще наблюдается постковидный синдром и ухудшается течение хронических заболеваний. Согласно глобальным статистическим данным американских исследователей, почти 90% пациентов, поступивших с COVID-19, имели сопутствующие заболевания [6], и почти в половине случаев это было ожирение. В работе французских ученых было продемонстрировано, что избыточную массу тела или ожирение имели 90% госпитализированных в отделение реанимации с СOVID-19 [7], тогда как обычно доля таких пациентов в отделении реанимации не превышает 50%.
По мнению экспертов, неблагоприятному течению инфекции СOVID-19 у лиц с ожирением способствует снижение резервов кардиореспираторной системы вследствие ограничения подвижности диафрагмы, а также нарушение регуляции иммунной системы на фоне хронического неспецифического воспаления, которые способствуют прогрессированию заболевания вплоть до развития критического состояния и полиорганной недостаточности [8]. Этиопатогенетическая взаимосвязь избытка жировой ткани с тяжелым течением COVID-19 и развитием постковидного синдрома объясняет высокую уязвимость данной категории пациентов и обуславливает необходимость персонифицированного подхода в лечении больных с COVID-19, а также разработки комплексных программ, направленных на лечение ожирения и изменение образа жизни пациентов [9].
Влияние ожирения на течение острой коронавирусной инфекции
Согласно результатам метаанализа, охватившего 54 исследования, каждый третий пациент с COVID-19 страдает ожирением [10]. Распространенность ожирения у больных, инфицированных SARS-CoV-2, с дыхательной недостаточностью еще выше: 90% имеют ИМТ выше 25 кг/м2 и средний ИМТ 30 кг/м2 [11].
Различные исследования наглядно демонстрируют взаимосвязь между тяжестью заболевания и увеличением ИМТ [11, 12]. Более того, было выявлено, что пациенты с ожирением в 1,5 чаще имеют положительные результаты теста на SARS-CoV-2, при диагностированном COVID-19 также в 1,5 чаще нуждаются в стационарном лечении и в последующем переводе в отделение интенсивной терапии, а также имеют большую вероятность летального исхода [13].
Взаимосвязь между значениями индекса массы тела и особенностями клинической картины новой коронавирусной инфекции была детально изучена в рамках исследований реальной клинической практики АКТИВ и АКТИВ 2 (n = 6396+2968 пациентов) [12]. Результаты показали, что увеличение значения ИМТ у больных, находящихся на стационарном лечении, было ассоциировано с более тяжелым течением COVID-19 в виде формирования острого повреждения почек, развития «цитокинового шторма» и повышением потребности в проведении таргетной терапии.
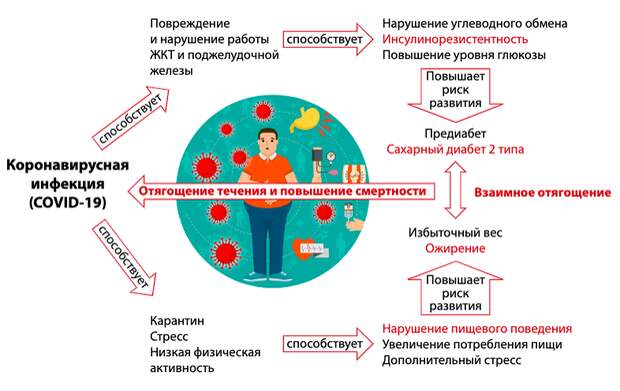
Демидова Т.Ю. с соавт. Особенности течения и последствия COVID-19 у пациентов с избыточным весом и ожирением. Уроки текущей пандемии. Ожирение и метаболизм. 2020
Кроме того:
- Течение коронавирусной инфекции у пациентов с избыточной массой тела сопровождалось более высокой температурой тела: фебрильная лихорадка более 38,5°С чаще регистрировалась у лиц с ИМТ выше 28 кг/м².
- У больных COVID-19 ожирение часто сочеталось с наличием миокардита. ИМТ≥30 кг/м² увеличивал шансы формирования миокардита в 1,84 раза.
- Наличие ожирения увеличивало потребность пациентов в антицитокиновой терапии для лечения COVID-19 в 1,7 раза.
- Повышенный ИМТ был ассоциирован с высокой летальностью больных, находящихся на стационарном лечении COVID-19, причем риск повышался сообразно цифрам ИМТ. При морбидном ожирении шанс летального исхода увеличивался в 1,78 раза [12].
Влияние ожирения на развитие и течение постковидного синдрома
По данным ВОЗ, время от начала заболевания COVID-19 до клинического выздоровления составляет в легких случаях около 2 недель, в тяжелых – от 3 до 6 нед. Однако по мере накопления клинических данных стало очевидно, что ряд симптомов может сохраняться в течение нескольких недель или даже месяцев. У некоторых пациентов симптомы так и не исчезли. Примечательно, что признаки поражения многих органов или систем, включая легкие, сердце, головной мозг, почки и сосудистую систему, могут отмечаться даже у пациентов, перенесших легкую форму COVID-19 [14].
На данный момент убедительно доказано, что риски развития так называемого постковидного синдрома и летальности в постковидном периоде выше у пациентов, страдающих ожирением [7, 15, 16]. В рамках исследований АКТИВ и АКТИВ 2 [12] было выявлено, что при ИМТ более 30 кг/м² шанс сохранения жалоб на общую слабость, одышку, повышение артериального давления, чувство сердцебиения, кашель, болевой синдром в области грудной клетки, потерю обоняния и/или вкуса, миалгии, диарею, артралгии, отеки нижних конечностей был выше: в 1,69 раза через 3 месяца, в 1,4 раза через 6 месяцев и в 1,43 раза через 12 месяцев после перенесенной инфекции SARS-CoV-2.
Ожирение также способствовало развитию в течение 6 мес после реконвалесценции таких заболеваний, как артериальная гипертензия, сахарный диабет 1 и 2 типа, ишемическая болезнь сердца, фибрилляция предсердий, бронхиальная астма, хроническая сердечная недостаточность, острый инфаркт миокарда, хроническая болезнь почек, острое нарушение мозгового кровообращения, артрит, онкологические заболевания, отсутствовавших до эпизода COVID-19. У пациентов старше 60 лет наличие ожирения увеличивало шанс летального исхода в 2,23 раза [12].
Патофизиология взаимосвязи ожирения и тяжелого течения COVID-19
Природа взаимосвязи ожирения и тяжелого течения COVID-19 подвергается в наши дни пристальному изучению. На данный момент уже определена роль, в частности, гиперактивации системы комплемента, хронического воспаления и наличия сопутствующих заболеваний, которые, в свою очередь, также считаются факторами риска плохого прогноза COVID-19 [17, 18].
- Известно, что ожирение сопровождается хроническим воспалением и продукцией провоспалительных цитокинов, таких как фактор некроза опухоли-α, интерлейкин-1 (ИЛ-1) и интерлейкин-6 (ИЛ-6) [19]. Есть данные о том, что жировая ткань может служить резервуаром для вирусов, в том числе, вируса SARS-CoV-2. Увеличение уровня продукции ИЛ-6 и экспрессии рецепторов к ИЛ-6 в жировой ткани способствует распространению вируса и повреждению органов и тканей пациентов с ковидной инфекцией [20]. Было обнаружено, что у пациентов, не переживших COVID-19, уровни ИЛ-6 повышены [5].
- COVID-19 приводит к активации как врожденного, так и адаптивного иммунитета. У некоторых пациентов эта активация, сопровождающаяся синтезом провоспалительных цитокинов, становится чрезмерной и приводит к «цитокиновому шторму» с последующим тяжелым повреждением легких, полиорганной недостаточностью и, в конечном итоге, смертью [17, 21, 22]. В этой связи сосуществование двух состояний, связанных с воспалением — ожирения и COVID-19, значительно повышает риск «гипервоспаления» и тяжелых последствий. [22, 23].
- Было доказано, что вирус COVID-19 заражает клетки посредством АПФ-2-зависимого механизма. Жировая ткань, включая ее эктопические резервуары, активно экспрессирует рецепторы АПФ-2 и протеазы, облегчающие проникновение вируса [24]. Это объясняет тенденцию к повышенной восприимчивости, более быстрому прогрессированию и более неблагоприятным исходам у людей с ожирением. Примечательно, что повышенная вирусная нагрузка у таких пациентов может сопровождаться и большим выделением вируса [8].
- Ожирение сопровождается резистентностью к лептину – цитокину, ответственному за регуляцию метаболического гомеостаза и поддержание иммунных функций [25]. Лептинорезистентность приводит к нарушению механизма продукции цитокинов и повышенной восприимчивости к инфекционным заболеваниям [26].
- Метаболические изменения, связанные с ожирением, нарушают мукоцилиарный транспорт, ответственный за удаление слизи из дыхательных путей, что облегчает заражение COVID-19 и ухудшает его течение [27].
- Ожирение снижает резервы кардиореспираторной системы, уменьшая объем форсированного выдоха и форсированную жизненную емкость легких [8]. Это приводит к нарушению функции легких и, впоследствии, к плохому ответу на искусственную вентиляцию легких [28].
- Ожирение увеличивает риск венозной и легочной тромбоэмболии [29], также как и COVID-19 [30], что, соответственно, увеличивает риск летального исхода, особенно у пациентов в критическом состоянии.
Роль висцерального ожирения в повышении риска осложнений COVID-19
Особенности патофизиологии COVID-19 позволяют взглянуть на проблему висцерального ожирения под новым углом, поскольку именно объем и распределение жировой ткани определяют тяжесть воспаления и степень метаболических нарушений [17]. Британские эксперты полагают, что антропометрические показатели, связанные с объемом жировой ткани и ее распределением способны дать более точные прогностические данные, чем ИМТ [31].
Было показано, что висцеральное ожирение является маркером неблагоприятных клинических исходов у пациентов с COVID-19 [32,33] и потенциальной необходимости в интенсивной терапии [34]. По всей вероятности, это связано со способностью висцерального жира секретировать провоспалительные цитокины, усиливающие негативные эффекты коронавируса [8]. Так, висцеральный жир в 2-3 раза активнее продуцирует интерлейкин-6, чем подкожный жир [35,36].
Актуальность терапии ожирения во время пандемии COVID-19
Понимание взаимосвязи между ожирением и тяжелым течением COVID-19 определяет важность выбора оптимальной стратегии по снижению веса, влияющей на риски развития неблагоприятных исходов COVID-19 у пациентов с ожирением и избыточной массой тела.
Актуальность данного вопроса особенно высока с учетом того, что пандемия COVID-19 с сопутствующими самоизоляцией, стрессом, нарушенным режимом работы и отсутствием адекватной физической нагрузки, также является фактором риска развития ожирения [37]. Европейские исследования выявили, что проведение национальных карантинных мероприятий стало причиной прибавок в весе и изменения пищевого поведения. Согласно данным итальянского исследования «Пищевые привычки и изменения образа жизни во время пандемии COVID-19», охватившего более 3,5 тысяч человек в возрасте от 12 до 86 лет, во время карантина 34,4% респондентов отметили усиление аппетита, у 40,3% наблюдалась незначительная прибавка в массе тела, а у 8,3% — значительная [38].
Отдельно стоит подчеркнуть, что ожирение может отрицательно сказаться не только на эффективности терапии COVID-19, но и на эффективности вакцин против COVID-19 по причине снижения иммунной памяти и, следовательно, долгосрочной защиты от повторных инфекций [39].
Снижение массы тела обеспечивает достоверное уменьшение уровней ИЛ-1β, ИЛ-8, ИЛ-6 и ФНО-α в крови и уменьшение выраженности хронического воспаления в целом, поэтому превентивное уменьшение веса у пациентов с ожирением будет способствовать снижению риска развития осложнений COVID-19 [40].
Лечение пациентов с лишним весом должно базироваться на постановке реалистичных целей, отсутствии вреда для здоровья и максимально длительном удержании достигнутой массы тела. В дополнение к мероприятиям, направленным на изменение образа жизни, пациентам с ИМТ>30 кг/м2 или с ИМТ>27 кг/м2 при наличии сопутствующих заболеваний может быть назначена лекарственная терапия [41].
Сибутрамин (Редуксин®) и его механизм действия
Одним из наиболее перспективных препаратов для лечения ожирения является сибутрамин – ингибитор обратного захвата нейромедиаторов: серотонина (53%), норадреналина (54%) и дофамина (16%). Препарат оказывает влияние на обе стороны энергетического баланса. Усиливая и пролонгируя чувство насыщения, сибутрамин уменьшает поступление энергии, и одновременно увеличивает ее расход вследствие усиления термогенеза [42]. Усиление термогенеза позволяет избежать характерного при снижении массы тела замедления скорости основного обмена, и сибутрамин является единственным из представленных в РФ лекарственных средств для лечения ожирения, обладающих таким свойством.
Активация бурой жировой ткани способствует окислению липидов и повышению утилизации глюкозы [40]. Снижение массы тела сопровождается увеличением концентрации в сыворотке крови липопротеинов высокой плотности и снижением количества триглицеридов, общего холестерина, липопротеинов низкой плотности, мочевой кислоты, глюкозы и гликированного гемоглобина (у пациентов с СД2) [43], что, в свою очередь снижает сердечно-сосудистый риск и способствует восстановлению метаболического здоровья.
В основе механизма действия препарата лежит ингибирование обратного захвата нейромедиаторов, в большей степени серотонина. В ряде исследований было показано, что лечение селективными ингибиторами обратного захвата серотонина (СИОЗС) снижает продукцию провоспалительных цитокинов [44], а риск смерти у пациентов с коронавирусной инфекцией, принимавших препараты группы СИОЗС, был меньше [45].
На российском рынке сибутрамин представлен препаратом Редуксин®, являющим собой комбинацию сибутрамина и микрокристаллической целлюлозы (МКЦ).
Влияние Редуксина® на патофизиологические аспекты ожирения и COVID-19
Эффективность и безопасность Редуксина® были подтверждены в рамках крупномасштабных клинических исследований – наблюдательные программы «Весна», «Примавера», «Аврора» суммарно включили 139 305 пациентов [46–48]. В результате данных исследований было показано, что на фоне терапии Редуксином® в течение 6–12 мес снижение веса достигало 15,0–20,0 кг, а уменьшение окружности талии за этот период составляло 10,6–16,0 см. Снижение веса на 5% и более за 3 мес терапии отмечалось более чем у 92,4% пациентов, причем за 12 мес более 50% пациентов снизили вес на 10–20%. Примечательно, что после завершения курса терапии почти 90% пациентов придерживались сформированного в процессе терапии пищевого поведения [49].
Выраженное влияние Редуксина® на объем висцерального жира подтверждается не только данными измерения окружности талии, но и магнитно-резонансными исследованиями. На фоне терапии сибутрамином объем висцеральной жировой ткани сократился на 22% [50], что крайне важно с учетом вклада висцеральной жировой ткани в поддержание хронического воспаления и ухудшение прогноза у пациентов с COVID-19.
Доказано, что Редуксин® способен снижать уровень С-реактивного белка [51, 52], фактора некроза опухоли α и интерлейкина-6 и повышать содержание в крови противовоспалительного цитокина ИЛ-10 [53]. На фоне приема препарата отмечена положительная динамика уровней адипонектина и лептина [54].
Нежелательные явления при приеме Редуксина® не превышали 5%, в большинстве случаев были обратимыми и не требовали отмены препарата. На фоне снижения массы тела при длительной терапии Редуксином® показатели АД и ЧСС оставались стабильными, что доказывает, что прием препарата под контролем врача является безопасным у пациентов без противопоказаний [46–48].
Заключение
Пандемия COVID-19 внесла серьезные коррективы и расставила новые акценты в вопросах профилактики и терапии многих неинфекционных заболеваний. Избыточная масса тела и ожирение являются значимым фактором риска тяжелого течения новой коронавирусной инфекции, включая поражение органов сердечно-сосудистой системы и почек. У пациентов с ожирением повышен риск летального исхода, причем как в острой стадии заболевания COVID-19, так и в постковидном периоде. Таким образом, выбор оптимальной стратегии по снижению веса в эпоху COVID-19 приобретает особую актуальность. Снижение массы тела может сыграть важнейшую роль в профилактике патологии органов дыхания, снижении рисков неблагоприятного течения и осложнений коронавирусной инфекции. Сегодня в арсенале отечественных специалистов имеется препарат Редуксин®, не только позволяющий снизить и удержать вес благодаря нормализации пищевых привычек и влиянию на скорость метаболизма, но и продемонстрировавший способность воздействовать на общие звенья патогенеза ожирения и коронавирусной инфекции за счёт снижения объемов висцерального жира, нормализации метаболических показателей, уровня про- и противовоспалительных цитокинов.
Литература:
1. Кокаева И.О., Жернакова Ю.В., Блинова Н.B. Эндотелиальная дисфункция у больных COVID-19 – ключевой механизм развития осложнений. Системные гипертензии. 2022;19(4):37-44. https://doi.org/10.38109/2075-082X-2022-4-37-44
2. Мартынов М.Ю., Боголепова А.Н., Ясаманова А.Н. Эндотелиальная дисфункция при COVID-19 и когнитивные нарушения. Журнал неврологии и психиатрии им. С.С. Корсакова. 2021;121(6):93-99. https://doi.org/10.17116/jnevro202112106193
3. Extrapulmonary complications of COVID-19: A multisystem disease? Zheng KI, Feng G, Liu WY, Targher G, Byrne CD, Zheng MH J Med Virol. 2021 Jan;93(1):323-335. https://doi.org/10.1002/jmv.26294
4. Wu Z., McGoogan J.M. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72314 cases from the Chinese Center for Disease Control and Prevention. JAMA. 2020; 323 (13): 1239-42. DOI: https://doi.org/10.1001/jama.2020.2648
5. Zhou F., Yu T., Du R., et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020; 95. DOI: https://doi.org/10.1016/S0140-6736(20)30566-3
6. Garg S, Kim L, Whitaker M, et al. Hospitalization Rates and Characteristics of Patients Hospitalized with Laboratory-Confirmed Coronavirus Disease 2019 - COVID-NET, 14 States, March 1-30, 2020. MMWR Morb Mortal Wkly Rep 2020;69:458-464. https://doi.org/10.15585/mmwr.mm6915e3
7. Simonnet A, Chetboun M, Poissy J, et al. High Prevalence of Obesity in Severe Acute Respiratory Syndrome Coronavirus?2 (SARS?CoV?2) Requiring Invasive Mechanical Ventilation. Obesity. 2020;28(7):1195-1199. https://doi.org/10.1002/oby.2283
8. Sattar N, McInnes IB, McMurray JJV. Obesity Is a Risk Factor for Severe COVID-19 Infection. Circulation. 2020;142(1):4-6. https://doi.org/10.1161/CIRCULATIONAHA.120.047659
9. Демидова Татьяна Юльевна, Волкова Екатерина Игоревна, Грицкевич Елена Юрьевна ОЖИРЕНИЕ И COVID-19: ФАТАЛЬНАЯ СВЯЗЬ // Инфекционные болезни: Новости. Мнения. Обучение. 2020. №S3 (34). URL: https://cyberleninka.ru/article/n/ozhirenie-i-covid-19-fatalnaya-svyaz (дата обращения: 09.03.2023).
10. Raeisi Tahereh, Mozaffari Hadis, Sepehri Nazaninzahra, Darand Mina, Razi Bahman, Garousi Nazila, Alizadeh Mohammad, Alizadeh Shahab. The negative impact of obesity on the occurrence and prognosis of the 2019 novel coronavirus (COVID-19) disease: a systematic review and meta-analysis. Eating and Weight Disorders - Studies on Anorexia, Bulimia and Obesity. 2021 Jul;27(3):893–911. doi: 10.1007/s40519-021-01269-3.
11. van der Voort Peter H.J., Moser Jill, Zandstra Durk F., Muller Kobold Anneke C., Knoester Marjolein, Calkhoven Cornelis F., Hamming Inge, van Meurs Matijs. Leptin levels in SARS-CoV-2 infection related respiratory failure: A cross-sectional study and a pathophysiological framework on the role of fat tissue. Heliyon. 2020 Aug;6(8):e04696. doi: 10.1016/j.heliyon.2020.e04696.
12. Arutyunov AG et al. The impact of BMI on the course of the acute SARS-COV-2 infection and the risks that emerge during the first year after the hospital discharge. Subanalysis evidence of the AKTIV and AKTIV 2 registries. Probl Endokrinol (Mosk). 2023 Jan 24;68(6):89-109. Russian. doi: 10.14341/probl13165.
13. Yang Jun, Tian Congmin, Chen Ying, Zhu Chunyan, Chi Hongyu, Li Jiahao. Obesity aggravates COVID?19: An updated systematic review and meta?analysis. Journal of Medical Virology. 2020 Nov;93(5):2662–2674. doi: 10.1002/jmv.26677.
14. Хасанова Д.Р., Житкова Юлия Владимировна, Васкаева Г.Р. ПОСТКОВИДНЫЙ СИНДРОМ: ОБЗОР ЗНАНИЙ О ПАТОГЕНЕЗЕ, НЕЙРОПСИХИАТРИЧЕСКИХ ПРОЯВЛЕНИЯХ И ПЕРСПЕКТИВАХ ЛЕЧЕНИЯ // Неврология, нейропсихиатрия, психосоматика. 2021. №3. URL: https://cyberleninka.ru/article/n/postkovidnyy-sindrom-obzor-znaniy-o-patogeneze-neyropsihiatricheskih-proyavleniyah-i-perspektivah-lecheniya (дата обращения: 09.03.2023).
15. Arutyunov G.P., Tarlovskaya E.I., Arutyunov A.G., i dr. Registr «Analiz dinamiki Komorbidnykh zabolevanii u patsienTov, perenesshIkh infitsiroVanie SARS-CoV-2» (AKTIV). Otsenka vliyaniya kombinatsii iskhodnykh soputstvuyushchikh zabolevanii u patsientov s COVID-19 na prognoz // Terapevticheskii arkhiv. — 2022. — T. 94. — C. 32-47.
16. Favre Guillaume, Legueult Kevin, Pradier Christian, Raffaelli Charles, Ichai Carole, Iannelli Antonio, Redheuil Alban, Lucidarme Olivier, Esnault Vincent. Visceral fat is associated to the severity of COVID-19. Metabolism. 2020 Nov;115:154440. doi: 10.1016/j.metabol.2020.154440.
17. Manolis AS, Manolis AA, Manolis TA, Apostolaki NE, Melita H. COVID-19 infection and body weight: A deleterious liaison in a J-curve relationship. Obes Res Clin Pract. 2021 Nov-Dec;15(6):523-535. doi: 10.1016/j.orcp.2021.10.006. Epub 2021 Nov 3.
18. Watanabe M., Risi R., Tuccinardi D., Baquero C.J., Manfrini S., Gnessi L. Obesity and SARS-CoV-2: a population to safeguard. Diabetes Metab Res Rev. 2020:e3325.
19. Mraz M, Haluzik M. The role of adipose tissue immune cells in obesity and low-grade inflammation. J Endocrinol. 2014;222(3):R113-R127. doi: https://doi.org/10.1530/JOE-14-0283
20. de Lucena TMC, da Silva Santos AF, de Lima BR, et al. Mechanism of inflammatory response in associated comorbidities in COVID-19. Dehmer M, ed. Diabetes Metab Syndr Clin Res Rev. 2020;14(4):597-600. doi: https://doi.org/10.1016/j.dsx.2020.05.025
21. Bohn M.K., Hall A., Sepiashvili L., Jung B., Steele S., Adeli K. Pathophysiology of COVID-19: mechanisms underlying disease severity and progression. Physiology (Bethesda) 2020;35:288–301.
22. Bertocchi I., Foglietta F., Collotta D., Eva C., Brancaleone V., Thiemermann C., et al. The hidden role of NLRP3 inflammasome in obesity-related COVID-19 exacerbations: lessons for drug repurposing. Br J Pharmacol. 2020;177:4921–4930.
23. Chiappetta S., Sharma A.M., Bottino V., Stier C. COVID-19 and the role of chronic inflammation in patients with obesity. Int J Obes (Lond) 2020;44:1790–1792.
24. Patel V.B., Basu R., Oudit G.Y. ACE2/Ang 1-7 axis: a critical regulator of epicardial adipose tissue inflammation and cardiac dysfunction in obesity. Adipocyte. 2016;5:306–311.
25. Pérez-Pérez A., Vilariño-García T., Fernández-Riejos P., Martín-González J., Segura-Egea J.J., Sánchez-Margalet V. Role of leptin as a link between metabolism and the immune system. Cytokine Growth Factor Rev. 2017;35:71–84.
26. Maurya R., Bhattacharya P., Dey R., Nakhasi H.L. Leptin functions in infectious diseases. Front Immunol. 2018;9
27. Ritter A., Kreis N.N., Louwen F., Yuan J. Obesity and COVID-19: molecular mechanisms linking both pandemics. Int J Mol Sci. 2020;21:5793.
28. Caci G., Albini A., Malerba M., Noonan D.M., Pochetti P., Polosa R. COVID-19 and obesity: dangerous liaisons. J Clin Med. 2020;9(8):2511
29. Yang G., De Staercke C., Hooper W.C. The effects of obesity on venous thromboembolism: a review. Open J Prev Med. 2012;2:499–509.
30. Kipshidze N., Dangas G., White C.J., Kipshidze N., Siddiqui F., Lattimer C.R., et al. Viral coagulopathy in patients with COVID-19: treatment and care. Clin Appl Thromb Hemost. 2020;26
31. Patel K.H.K., Li X., Quint J.K., Ware J.S., Peters N.S., Ng F.S. Increasing adiposity and the presence of cardiometabolic morbidity is associated with increased Covid-19-related mortality: results from the UK Biobank. BMC Endocr Disord. 2021;21:144
32. Földi M., Farkas N., Kiss S., Dembrovszky F., Szakács Z., Balaskó M., et al. Visceral adiposity elevates the risk of critical condition in COVID-19: a systematic review and meta-analysis. Obesity (Silver Spring) 2021;29:521–528
33. Pranata R., Lim M.A., Huang I., Yonas E., Henrina J., Vania R., et al. Visceral adiposity, subcutaneous adiposity, and severe coronavirus disease-2019 (COVID-19): systematic review and meta-analysis. Clin Nutr ESPEN. 2021;43:163–168.
34. Watanabe M., Caruso D., Tuccinardi D., Risi R., Zerunian M., Polici M., et al. Visceral fat shows the strongest association with the need of intensive care in patients with COVID-19. Metabolism. 2020;111
35. Fried S.K., Bunkin D.A., Greenberg A.S. Omental and subcutaneous adipose tissues of obese subjects release interleukin-6: depot difference and regulation by glucocorticoid. J Clin Endocrinol Metab. 1998;83:847–850.
36. Chait A., den Hartigh L.J. Adipose tissue distribution, inflammation and its metabolic consequences, including diabetes and cardiovascular disease. Front Cardiovasc Med. 2020;7:22.
37. Zupo Roberta, Castellana Fabio, Sardone Rodolfo, Sila Annamaria, Giagulli Vito Angelo, Triggiani Vincenzo, Cincione Raffaele Ivan, Giannelli Gianluigi, De Pergola Giovanni. Preliminary Trajectories in Dietary Behaviors during the COVID-19 Pandemic: A Public Health Call to Action to Face Obesity. International Journal of Environmental Research and Public Health. 2020 Sep;17(19):7073. doi: 10.3390/ijerph17197073.
38. Di Renzo L, Gualtieri P, Pivari F, et al. Eating habits and lifestyle changes during COVID-19 lockdown: an Italian survey. Dehmer M, ed. J Transl Med. 2020;18(1):229. doi: https://doi.org/10.1186/s12967-020-02399-5
39. Westheim A.J.F., Bitorina A.V., Theys J., Shiri-Sverdlov R. COVID-19 infection, progression, and vaccination: focus on obesity and related metabolic disturbances. Obes Rev. 2021;22
40. Демидова Т.Ю., Волкова Е.И., Грицкевич Е.Ю. Особенности течения и последствия COVID-19 у пациентов с избыточным весом и ожирением. Уроки текущей пандемии. Ожирение и метаболизм. 2020;17(4):375-384. https://doi.org/10.14341/omet12663
41. Дедов И.И., Мельниченко Г.А., Шестакова М.В., и др. Национальные клинические рекомендации по лечению морбидного ожирения у взрослых. 3-й пересмотр (лечение морбидного ожирения у взрослых) // Ожирение и метаболизм. — 2018. — Т. 15. — No1. — С. 53-70
42. Дедов И.И., Трошина Е.А., Мазурина Н.В., Галиева М.О. и др. Роль нейротрансмиттеров в регуляции энергетического гомеостаза и возможности медикаментозной коррекции его нарушений при ожирении // Ожирение и метаболизм. 2016. Т. 13, № 1. С. 9-15. DOI: https://doi.org/10.14341/OMET201619-15
43. Романцова Т.И. Сибутрамин: эффективность и безопасность применения в рутинной клинической практике // Ожирение и метаболизм. 2015. Т. 12, № 3. C. 18-24. DOI: https://doi.org/10.14341/omet2015318-24
44. Sales MC, Kasahara TM, Sacramento PM, Rossi ÁD, Cafasso MOSD, Oyamada HAA, Hygino J, Alvim F, Andrade RM, Cristina Vasconcelos C, Bento CAM. Selective serotonin reuptake inhibitor attenuates the hyperresponsiveness of TLR2+ and TLR4+ Th17/Tc17-like cells in multiple sclerosis patients with major depression. Immunology. 2021 Mar;162(3):290-305. doi: 10.1111/imm.13281. Epub 2020 Nov 23.
45. Oskotsky T, Maric I, Tang A, Oskotsky B, Wong RJ, Aghaeepour N, Sirota M, Stevenson DK. Mortality Risk Among Patients With COVID-19 Prescribed Selective Serotonin Reuptake Inhibitor Antidepressants. JAMA Netw Open. 2021 Nov 1;4(11):e2133090. doi: 10.1001/jamanetworkopen.2021.33090. https://www.rbc.ru/society/17/11/2021/61940a049a794703a4b65616
46. Аметов А.С. Отчет о программе ВЕСНА. Эффективное лечение ожирения — путь борьбы с эпидемией DIABETUS MELLITUS // Эндокринология: Новости. Мнения. Обучение. — 2013. — No2. — С. 12-16.
47. Дедов И.И., Мельниченко Г.А., Романцова Т.И. Стратегия управления ожирением: итоги Всероссийской наблюдательной программы «ПримаВера» // Ожирение и метаболизм. — 2016. — Т. 13. — No1. — C. 36-44. doi: https://doi.org/10.14341/omet2016136-44
48. Дедов И.И., Романцова Т.И., Шестакова М.В. Рациональный поход к терапии пациентов с СД2 и ожирением: Итоги Всероссийской наблюдательной программы «АВРОРА» // Ожирение и метаболизм. — 2018. — Т. 15. — No4. — C. 48-58 doi: https://doi.org/10.14341/omet10076
49. Cuellar G.E.M., Ruiz A.M., Monsalve M.C.R. et al. Six-month treatment of obesity with sibutramine 15 mg: a double-blind, placebo-controlled monocenter clinical trial in a Hispanic population. // Obes Res. 2000; 8:71-82.
50. Luque C.A, Rey J.A. The discovery and status of sibutramine as an anti-obesity drug. // Eur J Pharmacol 2002; 440,119-128
51. Valsamakis G., McTernan P.G., Chetty R. et al. Modest weight loss and reduction in waist circumference after medical treatment are associated with favorable changes in serum adi-pocytokines // Metabolism. - 2004. - Vol. 53. - P. 430-434.
52. Shechter M., Beigel R., Freimark D. et al. Shortterm sibutramine therapy is associated with weight loss and improved endothelial function in obese patients with coronary artery disease // Am. J. Cardiol. - 2006. – Vol. 97. – P. 1650-1653.
53. Jung S.H., Park H.S., Kim K.S. et al. Effect of weight loss on some serum cytokines in human obesity: increase in IL-10 after weight loss // J. Nutr. Biochem. - 2008. - Vol. 19. - P. 371-375.
54. Г.А. Матвеев, Т.И. Голикова, А.А. Васильева, Е.Ю. Васильева, А.Ю. Бабенко, Е.В. Шляхто. Сравнение эффектов терапии ожирения лираглутидом и сибутрамином. Ожирение и метаболизм. – 2021. – Т. 18. – №2. – С. 218-228 doi: https://doi.org/10.14341/omet1249
Свежие комментарии