Британские химики обнаружили простой, эффективный и «пребиотически правдоподобный» способ неферментативного аминоацилирования РНК, то есть присоединения аминокислот к РНК без помощи сложных катализаторов, таких как белковые ферменты или рибозимы. Решить эту задачу пытались давно, но до сих пор удавалось найти только малоэффективные и не очень правдоподобные решения. Новое исследование показало, что аминоацил-тиолы избирательно реагируют с двухцепочечными РНК в водном растворе, почти не вступая в другие реакции и не давая ненужных побочных продуктов. В результате аминокислота аккуратно присоединяется как раз к тому месту молекулы РНК, к которому ее присоединяют ферменты аминоацил-тРНК-синтетазы в ходе аминоацилирования транспортных РНК — ключевого этапа синтеза белка в живых клетках. Исследователи также показали возможность абиогенного синтеза аминоацил-тиолов в правдоподобных условиях. Открытие показало вероятные первые шаги в эволюции программируемого синтеза белка — главного эволюционного достижения РНК-мира и главного «ноу-хау» земной жизни.
Появление программируемого рибосомного синтеза белков (см. Трансляция) — важнейшее эволюционное событие, открывшее перед примитивными репликаторами РНК-мира небывалые возможности и обеспечившее успех всего удивительного предприятия под названием «земная жизнь». Расшифровка деталей этого события — сложная и увлекательная научная задача, над которой ученые небезуспешно работают (см. ссылки в конце новости). Однако нерешенных проблем еще много. Одна из них — это проблема аминоацилирования РНК (то есть присоединения аминокислот к РНК) в мире, где еще не было белковых ферментов.
1. Как присоединить аминокислоту к РНК?
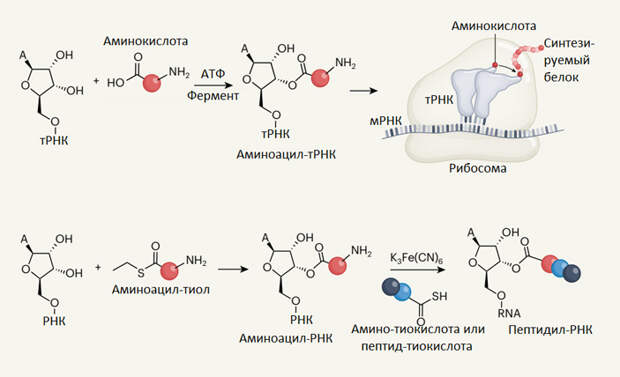
В современных живых клетках синтез белка начинается с того, что специальные ферменты — аминоацил-тРНК-синтетазы — присоединяют аминокислоты к молекулам тРНК. Причем делают они это не абы как, а в строго определенном месте — к OH-группе второго или третьего атома углерода рибозы последнего нуклеотида на 3’-конце молекулы тРНК. В современных тРНК там всегда стоит нуклеотид А (аденозин).
Именно аминоацил-тРНК-синтетазы ответственны за считывание генетической информации, которая записана в матричных РНК, поскольку они присоединяют каждую аминокислоту только к тем тРНК, у которых имеется соответствующий антикодон. Интересные идеи о том, как могла эволюционировать эта специфичность, формирующая генетический код, изложены в интервью Бориса Штерна с Михаилом Никитиным «Как в мире РНК появились белки» («Троицкий вариант» №3(397), 2024).
Но современные аминоацил-тРНК-синтетазы — это большие и сложные белки. Они прошли долгий эволюционный путь, который без системы программируемого синтеза белков не мог даже начаться. Получается как будто замкнутый круг: трансляция, как мы ее знаем сегодня, невозможна без аминоацил-тРНК-синтетаз, а аминоацил-тРНК-синтетазы не могли даже начать эволюционировать, пока не было механизма трансляции. Из этого, очевидно, следует, что в прошлом существовали более примитивные версии механизма трансляции, которые обходились без сложных белковых ферментов.
Логично предположить, что на каком-то этапе эволюции РНК-мира аминоацилирование РНК катализировалось рибозимами. Рибозимы, способные выполнять эту функцию, известны и активно изучаются (см., например: N. Li, F. Huang, 2005. Ribozyme-Catalyzed Aminoacylation from CoA Thioesters; N. Chumachenko et al., 2009. Rapid and Simple Ribozymic Aminoacylation Using Three Conserved Nucleotides).
Однако еще интереснее было бы найти эффективный и реалистичный («пребиотически правдоподобный») способ аминоацилирования РНК вообще без сложных, проэволюционировавших катализаторов: не только без белковых ферментов, но и без рибозимов. Обнаружение такого способа показало бы, что эволюция программируемого синтеза белков могла сделать свои первые шаги уже на очень ранних этапах существования РНК-мира. В конце концов, могло бы выясниться, что примитивным древним репликаторам, может быть, совсем недолго пришлось мучиться без арсенала разнообразных, худо-бедно кодируемых, наследуемых, эволюционирующих полипептидов.
2. Главное — правильно активировать аминокислоту
Попытки найти простой и надежный способ неферментативного аминоацилирования РНК ранее уже предпринимались, но приносили лишь весьма скромные результаты. Как теперь выяснилось, главная проблема была в том, что исследователи использовали неоптимальные способы активации аминокислот.
Чтобы аминокислота присоединилась к РНК, аминокислоту сначала нужно активировать, то есть перевести в форму, охотно вступающую в интересующую нас химическую реакцию. Активировать аминокислоты можно по-разному. Например, в современных живых клетках аминоацил-тРНК-синтетаза активирует аминокислоту, заставляя ее прореагировать с АТФ (получается аминоацил-аденилат). Только после этого фермент может прикрепить аминокислоту к тРНК.
С точки зрения пребиотической химии проблема здесь в том, что без помощи фермента аминокислота, активированная таким способом, совершенно не желает присоединяться к РНК. Вместо этого она вступает в разные другие реакции, например, с водой (аминоацил-аденилат гидролизуется, и получается АМФ + неактивированная аминокислота). Или она реагирует с другой активированной аминокислотой, и тогда получается случайный дипептид. Это тоже тупик, из которого не просматривается путей к программируемому синтезу белков.
Ученые пробовали и разные другие способы активации аминокислот. В частности, проводились эксперименты с аминоацил-фосфатами, аминоацил-имидазолами и N-карбоксиангидридами (циклическими производными аминокислот, обладающими высокой реакционной способностью). Во всех случаях получалось примерно одно и то же: активированные аминокислоты либо быстро гидролизовались, либо соединялись друг с другом, формируя случайные пептиды без всякого контроля со стороны РНК. С молекулами РНК они если иногда и реагировали, то неохотно (выход аминоацил-РНК был низким), неспецифично (не только с 2’, 3’-OH последнего нуклеотида на 3’-конце РНК, но и с другими OH-группами, аминогруппами и фосфатами) и при этом на фоне огромного количества побочных реакций.
3. Тиолы — элегантное решение проблемы
Химики из Университетского колледжа Лондона нашли удивительно простое и изящное решение этой проблемы. Они подумали, что все применявшиеся ранее способы активации аминокислот, возможно, просто слишком мощные для данной задачи. Реакционная способность молекулы оказывается слишком высокой, и она начинает реагировать со всем подряд. Ученые решили попробовать более мягкий способ активации, причем не какой-то надуманный и высосанный из пальца, а вполне «биологичный» (похожий на то, что используется в реальных живых клетках) и даже «пребиотически правдоподобный» (реализуемый в условиях, которые предположительно могли существовать в «колыбели жизни», например, в маленьком теплом геотермальном пруду).
Исследователи использовали для активации аминокислот тиолы — сернистые аналоги спиртов (они несут SH-группу вместо OH-группы). Тиолы могут реагировать с аминокислотами, давая аминоацил-тиолы. Аминоацил-тиол — это тиоэфир аминокислоты и тиола с общей формулой R1-CH(NH2)-CO-S-R2 (например, на рис. 1 изображен аминоацил-этантиол, у которого в качестве R2 — этильная группа CH2-CH3, а R1 — боковая цепь аминокислоты — на рисунке не отображена).
Использовать тиолы как средство переноса остатка кислоты (в данном случае аминокислоты) на какой-либо субстрат (в данном случае на РНК) — это не кабинетная фантазия химиков-теоретиков, а самый что ни на есть «биологичный», естественный способ решения данной задачи. В реальных биохимических процессах этот метод используется сплошь и рядом, чаще всего при помощи специальной вспомогательной молекулы с тиольной группой — кофермента А. Кофермент А есть у всех живых существ без исключения, а биохимические процессы с его участием явно старше последнего общего предка всех клеточных форм жизни (LUCA). Недавно, кстати, был открыт правдоподобный путь абиогенного синтеза пантетеина — самого главного, несущего тиольную группу компонента кофермента А (J. Fairchild et al., 2024. Prebiotically plausible chemoselective pantetheine synthesis in water). Во многих ситуациях пантетеин и сам, без остальных частей кофермента, справляется со своими задачами.
Оказалось, что аминоацил-тиолы охотно и очень избирательно реагируют с одиночными рибонуклеозидами, аккуратно сажая аминокислоту на «правильное» место, то есть на 2-й или 3-й углерод рибозы (гораздо реже — на 5-й) (рис. 2). Ненужных побочных продуктов при этом образуется минимальное количество. Особенно важно, что аминоацил-тиолы практически не реагируют друг с другом и не дают случайных пептидов. Более того, аминоацил-тиолы, как выяснилось, не хотят реагировать даже с субстратами, похожими по своим свойствам на 2’,3’-OH рибозы — например, с глицеролом, у которого тоже есть ОН-группы, расположенные по соседству.
Разобравшись с одиночными нуклеозидами, исследователи перешли к экспериментам с молекулами РНК. Оказалось, что к одноцепочечным РНК аминоацил-тиолы присоединяют аминокислоты как попало — не только к 2’,3’-OH последнего нуклеотида на 3’-конце (как при реальном аминоацилировании тРНК), но и к другим местам, например, к свободным 2’-OH нуклеотидов, находящихся в середине цепочки. Совсем другая картина получается при взаимодействии аминоацил-тиолов с двухцепочечными РНК. В этом случае аминокислота присоединяется исключительно в «правильном» месте (рис. 3).
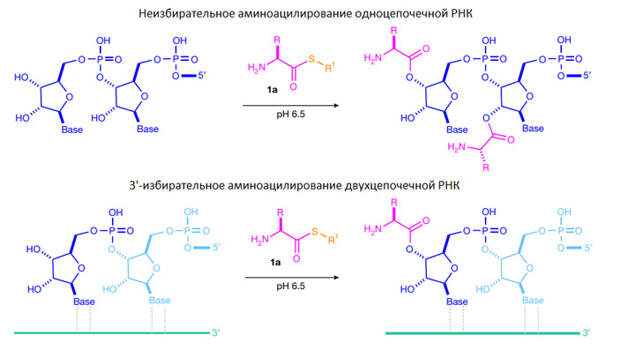
Дальнейшие эксперименты показали, что с помощью аминоацил-тиолов можно присоединить к РНК широкий круг разнообразных аминокислот. Авторы приводят список из 14 протеиногенных аминокислот, для которых это было экспериментально подтверждено (Ala, Arg, Asp, Glu, Gln, Gly, His, Leu, Lys, Met, Phe, Pro, Ser, Val). Про оставшиеся шесть (Asn, Cys, Ile, Thr, Trp, Tyr) в статье ничего не сказано: видимо, их не проверяли. Все равно это впечатляющий результат, особенно если учесть, что те способы неферментативного аминоацилирования РНК, которые исследовались ранее, были настолько малоэффективны, что их даже толком не проверяли на толерантность к разнообразию боковых цепей аминокислот.
Аминоацилирование двухцепочечных РНК при помощи аминоацил-тиолов происходит одинаково успешно независимо от того, какой из четырех нуклеотидов находится на 3’-конце. Реальные тРНК всегда заканчиваются последовательностью CCA-3’, но это может быть и относительно поздним приобретением.
Полученные результаты выглядят настолько яркими и специфическими, что возникает ощущение, что мы имеем дело не с чем-то «придуманным», а с чем-то «угаданным» (как и в случае со способом абиогенного синтеза активированных рибонуклеотидов, открытым британскими химиками в 2009 году, с чего началась настоящая революция в пребиотической химии, см. Химики преодолели главное препятствие на пути к абиогенному синтезу РНК, «Элементы», 18.05.2009). Иными словами, предположение о том, что на заре эволюции рибосомного синтеза белков аминоацил-тиолы действительно служили для аминоацилирования каких-то прото-тРНК, кажется теперь очень соблазнительным и правдоподобным.
4. Перспективы дальнейших открытий
Проверяемое следствие из гипотезы о роли аминоацил-тиолов на ранних этапах эволюции трансляции заключается в том, что если это правда, то от этой отправной точки должны найтись пути к решению смежных проблем. Авторы рассматривают три таких проблемы и намечают подходы к их решению.
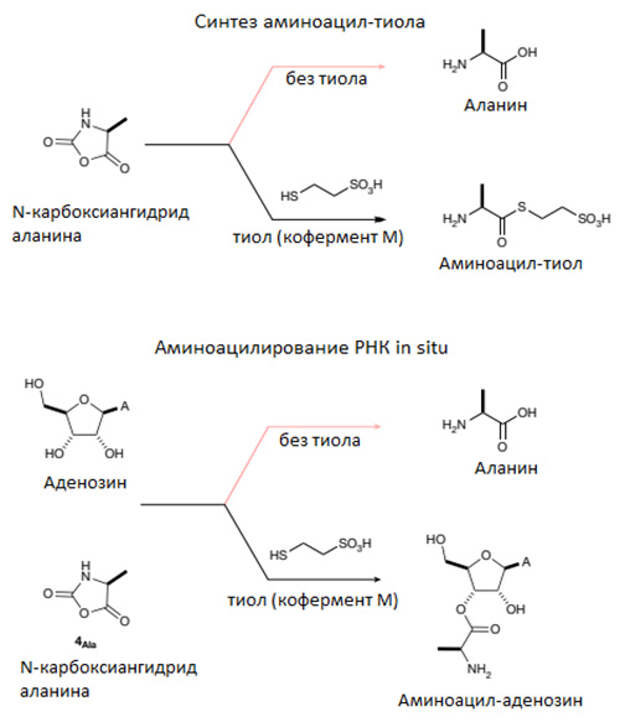
Проблема №1: возможен ли абиогенный синтез аминоацил-тиолов? Авторы показали, что пребиотически правдоподобная активированная аминокислота (Ala-NCA, N-карбоксиангидрид аланина), которая в обычной ситуации быстро гидролизуется и превращается в аланин + С02, в присутствии тиола дает аминоацил-тиол, который затем можно использовать для аминоацилирования РНК. Более того, оба процесса — синтез аминоацил-тиола и аминоацилирование РНК — идут в одних и тех же условиях, поэтому их можно проводить в одной пробирке. Эксперимент выглядит так: смешиваем в пробирке N-карбоксиангидрид аланина и РНК — получаем ту же самую РНК и не присоединившийся к ней аланин (потому что N-карбоксиангидрид гидролизовался). Добавляем к исходной смеси тиол — и на выходе сразу получаем аминоацил-РНК. Суть в том, что тиол не дает N-карбоксиангидриду гидролизоваться, а вместо этого сам реагирует с ним, образуя аминоацил-тиол, который затем аминоацилирует РНК (рис. 4). Это не просто возможное решение проблемы №1 — это красивое решение, открывающее новую грань удивительной «приспособленности» тиолов к функции аминоацилирования РНК.
Проблема №2: как могла начаться эволюция простейших форм кодирования? Если на ранних этапах эволюции рибосомного синтеза белка действительно был этап аминоацилирования прото-тРНК при помощи аминоацил-тиолов, то хорошо бы понять, как из такого исходно неизбирательного процесса (когда к РНК присоединяется первая попавшаяся аминокислота) могло эволюционировать избирательное аминоацилирование, при котором выбор присоединяемой аминокислоты зависит от последовательности нуклеотидов в прото-тРНК.
Ферменты аминоацил-тРНК-синтетазы узнают свои тРНК не по антикодону, а по последовательности нуклеотидов в двуспиральном участке, ближайшем к месту присоединения аминокислоты (в так называемом акцепторном стебле; есть гипотеза, что антикодон возник позже в результате дупликации этого участка; см. Как в мире РНК появились белки). Нечто похожее обнаружили и авторы в своих дальнейших экспериментах. Оказалось, что то, какие именно аминокислоты будут с большей охотой присоединяться аминоацил-тиолами к 3’концу РНК, зависит от того, какие нуклеотиды находятся на 5’-конце комплементарной цепи. Эти 5’-концы, особенно «нависающие», то есть выступающие немного за 3’-конец, фактически работают как маленькие рибозимы. Они могут, во-первых, повышать эффективность аминоацилирования, во-вторых — делать его более избирательным. Например, если на 3’-конце находится нуклеотид U, а на 5’-конце — некомплементарный U и «нависающий» G, то к такой РНК охотнее присоединяется (с помощью соответствующего аминоацил-тиола) аминокислота фенилаланин.
Это тоже красивый результат, показывающий, ни много ни мало, возможное начало эволюции генетического кода.
Проблема №3: можно ли от неферментативного аминоацилирования РНК каким-то простым способом перейти к синтезу пептидил-РНК? Речь идет о переходе ко второму этапу синтеза белка, который показан справа вверху на рис. 1, то есть к удлинению пептидной цепочки, сидящей на РНК (элонгация, см. Translation). Здесь авторам тоже нашлось, что сказать, хотя в данном случае предложенное ими решение явно не окончательное. Это скорее даже не решение, а демонстрация принципиальной возможности решения. Они показали, что приделать вторую аминокислоту или даже коротенький пептид к аминокислоте, уже сидящей на РНК, можно при посредничестве амино-тиокислот или пептид-тиокислот (рис. 1, справа внизу). Интересно здесь то, что функции аминоацил-тиолов и амино-тиокислот в данной ситуации оказываются очень специфичными и взаимодополняющими. Аминоацил-тиолы хорошо умеют присоединять аминокислоту к РНК, но не к другой аминокислоте, уже сидящей на РНК. Амино-тиокислоты — наоборот, не умеют решать первую задачу, но неплохо справляются со второй.
Как отсюда перейти к тому способу элонгации, который используется в настоящем рибосомном синтезе белка — когда от одной тРНК отделяется пептид и присоединяется к аминокислоте, сидящей на другой тРНК — не совсем очевидно. Но, по крайней мере, показано, что переключение с одного процесса на другой — с аминоацилирования на некое подобие элонгации — можно осуществить без помощи ферментов и рибозимов. Это уже немало. Да и грех было бы требовать от одного исследования, чтобы в нем были решены все оставшиеся проблемы происхождения трансляции. Авторы и так сделали огромный шаг вперед.
Источник: Jyoti Singh, Benjamin Thoma, Daniel Whitaker, Max Satterly Webley, Yuan Yao & Matthew W. Powner. Thioester-mediated RNA aminoacylation and peptidyl-RNA synthesis in water // Nature. 2025. DOI: 10.1038/s41586-025-09388-y.
См. также:
1) Как в мире РНК появились белки. Интервью Бориса Штерна с Михаилом Никитиным // «Троицкий вариант» №3(397), 2024.
2) Молекулы РНК умеют синтезировать пептиды при помощи реликтовых нестандартных нуклеотидов, «Элементы», 23.05.2022.
3) Борис Штерн, Александр Марков, Армен Мулкиджанян, Евгений Кунин, Михаил Никитин. Вероятность зарождения жизни // «Троицкий вариант» №6(275), 2019.
4) Тайна происхождения рибосом разгадана?, «Элементы», 27.02.2009.

Свежие комментарии