
В процессе эволюции у летучих мышей значительно усовершенствовались протеинкиназы R — белки для распознавания вирусной РНК. Более того, из-за неоднократных дупликаций арсенал этих белков у летучих мышей гораздо обширнее, чем у других млекопитающих. Это, по-видимому, помогает им уживаться с полчищами вирусов. Но не со всеми. Вирусы тоже находят способ обойти защиту и нейтрализовать протеинкиназу. Новое исследование на большом числе геномов раскрывает перед нами историю гонки вооружений между летучими мышами и их вирусами.
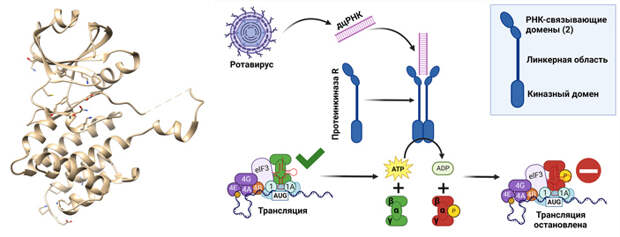
За сложным и малопонятным на первый взгляд названием «протеинкиназа R» (protein kinase R) скрывается один из самых универсальных и прямых механизмов распознавания вирусной угрозы клетками позвоночных. Этот белок распознает РНК, скрученную в двойную спираль. Такая структура абсолютно несвойственна здоровым клеткам: в нормально функционирующей клетке двойную спираль образует только ДНК. Появление в клетке двуцепочечной РНК может означать только одно — в клетку вторгся вирус. Тут и «срабатывает» протеинкиназа R. При связывании с двуцепочечной РНК она приобретает способность «навешивать» фосфатные группы на белок eIF2 (необходимый для синтеза новых белков), тем самым блокируя его функцию. Синтез белка в клетке останавливается, что лишает вирус возможности размножаться (рис. 2).
Такой механизм защиты эффективен прежде всего против вирусов, чей геном представлен двуцепочечной РНК — например, ротавирусов, вызывающих инфекционный гастроэнтерит, известный как «кишечный грипп». Но не только против них: при заражении некоторыми ДНК-содержащими вирусами в клетках тоже образуется двуцепочечная РНК (A. T. Olson et al., 2022. Antagonism of Protein Kinase R by Large DNA Viruses). Причины этого до конца неясны, но, возможно, она формируется из комплементарных друг другу транскриптов с обеих цепей ДНК. Такой механизм, в частности, предполагается для вируса коровьей оспы и цитомегаловируса человека.
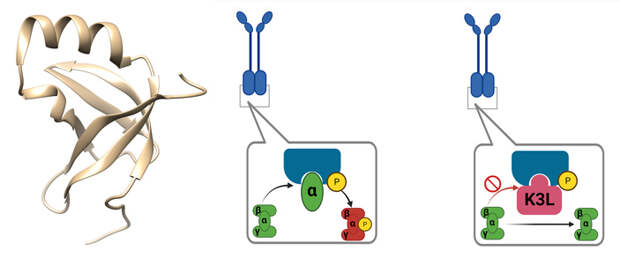
Это сильно демаскирует в клетке такие распространенные вирусы, как поксвирусы (к которым относится вирус черной оспы и печально известный вирус оспы обезьян), герпесвирусы (вызывающие в том числе ветрянку и «простуду на губах») и даже ортомиксовирусы (вирусы гриппа) — несмотря на то, что их геном, вообще-то, представлен одноцепочечной РНК. В общем, протеинкиназа R — довольно простой компонент врожденного противовирусного иммунитета с широким спектром действия. Поэтому, чтобы выжить в клетке позвоночного, вирусу надо как-то от нее укрыться. Для этого у вирусов есть белки-антагонисты — молекулярные «обманки», которые имитируют по своей структуре субъединицу eIF2 — естественную мишень протеинкиназы R. Занимая ее место в связывающем участке, они не дают протеинкиназе присоединить фосфатную группу к настоящему eIF2 и тем самым заблокировать синтез белка (рис. 3). Характерный пример такого белка — белок K3 (также известный как K3L) вируса коровьей оспы. Сходные антагонисты есть также у вирусов герпеса и вирусов гриппа.
Наличие протеинкиназы R у позвоночных и ее блокаторов у вирусов создает условия для молекулярной «гонки вооружений». Протеинкиназа R эволюционирует в сторону уклонения от блокировки вирусными антагонистами, но сохранения способности связываться с альфа-субъединицей eIF2 (что не так просто, так как связывающие участки обоих белков частично перекрываются). А вирусы совершенствуют свои белки-антагонисты, стараясь эффективнее блокировать протеинкиназу. Причем в разных эволюционных ветвях это происходит совершенно по-разному.
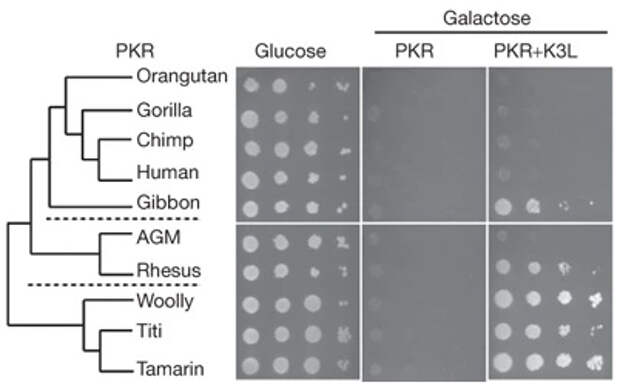
В 2009 году в жернале Nature была опубликована статья о «гонке вооружений» между протеинкиназой R приматов (включая человека) и белками-антагонистами поксвирусов (N. C. Elde et al., 2008. Protein kinase R reveals an evolutionary model for defeating viral mimicry). Авторы методами биоинформатики обнаружили в протеинкиназах R обезьян и людей множество участков, на которые действовал интенсивный направляющий отбор. В качестве модельного поксвируса авторы использовали вирус коровьей оспы (хоть он и не эволюционировал среди приматов) — и также нашли в нем многочисленные следы давления отбора. Далее исследователи проверили in vitro (в модельной системе на основе дрожжей), как протеинкиназы R разных приматов реагируют на белок-антагонист, содержащийся в вирусе коровьей оспы. В то время как у большинства человекообразных обезьян протеинкиназы R оказались к нему резистентными, протеинкиназа R гиббона успешно им блокировалась.
Действие направленного отбора на уровне последовательности гена проявляется заменами нуклеотидов. Но как понять, произошли замены случайно или под действием естественного отбора? В биоинформатике для этого существуют разные методы. Можно просто посчитать соотношение несинонимичных замен к синонимичным (как сделали авторы в упомянутой выше статье про приматов) — чем оно больше, тем больше вероятность направленного отбора. Можно построить более сложные математические модели эволюции с направленным отбором и без него и сравнить с ними имеющийся набор белков — так сделали авторы обсуждаемой статьи.
Почему-то из всех человекообразных обезьян только гиббоны оказались восприимчивы к блокированию протеинкиназы вирусом коровьей оспы (рис. 4), хотя с этим вирусом не сталкивался никто из приматов (кроме современных людей). Объяснение звучит просто: все человекообразные обезьяны, кроме гиббонов, успели давным-давно столкнуться (возможно, неоднократно) с эпидемией какого-то поксвируса, у которого анатагонист K3L похож на родственный белок вируса коровьей оспы. В общем, протеинкиназы R и их вирусные антагонисты интенсивно эволюционировали в разных линиях приматов, — но под действием разных факторов отбора.
Недавно в журнале Science Advances вышла статья с описанием аналогичного исследования протеинкиназ R летучих мышей. Для этого авторам пришлось секвенировать геномы пятнадцати дополнительных видов — тех, что уже были в открытом доступе, было недостаточно для исследования. В этих геномах записана история аналогичной гонки вооружений, но, как и следовало ожидать — еще более эпической.
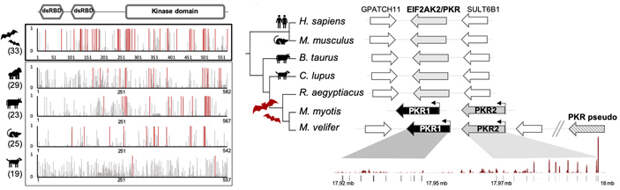
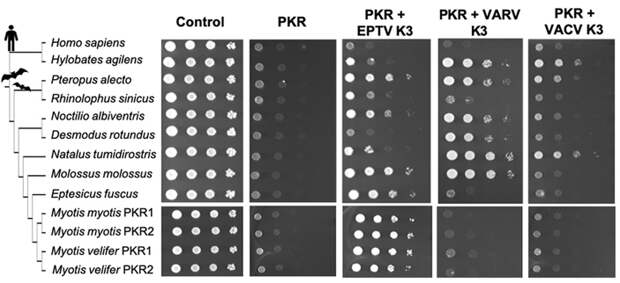
Во-первых, участков, где действовал направленный отбор, в протеинкиназах R летучих мышей не в пример больше, чем в родственных им белках приматов и других млекопитающих (рис. 5, а). Во-вторых, если у приматов эти участки в основном концентрируются в одной из четырех крупных областей — киназном домене, то у летучих мышей протеинкиназы подвергались давлению отбора по всей нуклеотидной последовательности. Но и этого эволюции показалось мало: у представителей рода Ночницы (Myotis) ген протеинкиназы R дуплицировался (удвоился) еще на заре существования рода (рис. 5, б). Некоторые ночницы позже обзавелись дополнительными копиями, обеспечив себе усиленную защиту от вирусов, с которыми ночницам приходится сосуществовать.
На этот раз в уже знакомом нам тесте на дрожжевых клетках были использованы антагонисты трех разных поксвирусов — вируса оспы кожанов (Eptesipox virus), поражающего летучих мышей с летальным исходом (G. L. Emerson et al., 2013. Novel Poxvirus in Big Brown Bats, Northwestern United States), вируса коровьей оспы и вируса натуральной оспы. Выяснилось, что у каждого вида протеинкиназа R реагирует на три этих вируса по-разному. Большая часть протеинкиназ, включая протеинкиназы ночниц, успешно «справлялись» с блокаторами из вирусов натуральной и коровьей оспы, но были восприимчивы к блокатору из вируса оспы кожанов. Он успешно подавлял активность протеинкиназ R ночниц и естественного хозяина — большого бурого кожана (Eptesicus fuscus).
Успешное срабатывание протеинкиназы R летучих мышей на белки человеческой и коровьей оспы можно объяснить так же, как в случае с приматами: летучие мыши за свою эволюционную историю взаимодействовали со сходными поксвирусами. Но почему вирус оспы кожанов успешно уклоняется от протеинкиназ R самих кожанов и ночниц? Вирус оказался тоже не лыком шит и в процессе эволюции приобрел вставку — дополнительную аминокислотную последовательность — вблизи C-конца. Она значительно усилила его связывание с протеинкиназами R, перед которым даже летучие мыши оказались безоружны — несмотря на пройденный их протеинкиназами впечатляющий эволюционный путь. Это полностью укладывается в гипотезу Черной королевы — видам «приходится бежать со всех ног, чтобы только оставаться на месте!» И все-таки летучие мыши делают это не зря — несомненно, совершенные протеинкиназы R являются одним из десятков молекулярных факторов их успешного сосуществования с вирусами. Про него написано уже много: см., например, новость Какой переносчик инфекций опаснее для человека — грызуны или летучие мыши? («Элементы», 27.02.2013) и задачу Опасные связи. «Благодаря» пандемии коронавируса таких публикаций стало еще больше (в качестве примера приведем статью Уроки толерантности от летучей мыши: как ужиться с полчищем смертоносных вирусов, «Биомолекула», 05.03.2021). И тем не менее мы практически впервые смогли воочию увидеть напряженную и драматическую коэволюцию вирусов и их крылатых хозяев.
Кроме того, это исследование может принести и новые открытия, не вошедшие в обсуждаемую статью в Science Advances. В пятнадцати геномах, секвенированных для этой работы, могут скрываться не описанные пока секреты выживания летучих мышей в вирусном мире, которые еще ждут своих первооткрывателей.
Источник: Stéphanie Jacquet, Michelle Culbertson, Chi Zhang, Adil El Filali, Clément De La Myre Mory, Jean-Baptiste Pons, Ondine Filippi-Codaccioni, M. Elise Lauterbur, Barthélémy Ngoubangoye, Jeanne Duhayer, Clément Verez, Chorong Park, Clara Dahoui, Clayton M. Carey, Greg Brennan, David Enard, Andrea Cimarelli, Stefan Rothenburg, Nels C. Elde, Dominique Pontier, Lucie Etienne. Adaptive duplication and genetic diversification of protein kinase R contribute to the specificity of bat-virus interactions // Science Advances. 2022. DOI: 10.1126/sciadv.add7540.
Георгий Куракин




Свежие комментарии