Молекула простого вещества N2 — наиболее устойчивая и распространенная форма существования азота. Азот необходим для всего живого, но в таком виде он недоступен для потребления. Перевод азота в биологически доступную форму (азотфиксация) является весьма нетривиальной задачей, на выполнение которой способны лишь считанные виды бактерий. Человечество освоило искусственный метод азотфиксации только в начале XX века, начав масштабный промышленный синтез аммиака по методу Габера — Боша. Новое время диктует новые требования к экономичности и экологичности методов связывания азота. Среди множества альтернатив плазменные методы часто выделяют как наиболее перспективные. В новом исследовании команда химиков из Китая и России впервые продемонстрировала возможность связать азот водной плазмой и получить в результате два ценных продукта: гидроксиламин и нитроксил. В отличие от классического синтеза аммиака, новый метод можно реализовать при комнатной температуре и атмосферном давлении, а для его осуществления достаточно иметь элементарное разрядное устройство, воду и электричество.
Азот атмосферный и биогенный
В течение всей своей жизни человек окружен молекулярным азотом (N2), который составляет основную часть земной атмосферы. Поэтому на первый взгляд кажется неудивительным, что атомы азота входят во многие жизненно важные химические системы в человеческом теле (да и в любом живом организме). В живых клетках на долю «биогенного» азота приходится до 10% состава. Он содержится в нуклеиновых кислотах (ДНК и РНК), в белках, в аденозинтрифосфорной кислоте (АТФ) и во множестве других органических соединений. Азот даже иногда рассматривают как альтернативную углероду основу жизни (см. Hypothetical types of biochemistry).
Однако переход азота из молекулярного состояния в биохимические соединения является крайне необычным природным процессом. Атмосферный азот может быть «связан» только прокариотными организмами — особыми азотфиксирующими бактериями и археями. В процессе азотфиксации данные организмы, и только они, переводят N2 из исходного инертного состояния в реакционноспособное, восстанавливая его в аммиак NH3. На этом пути им приходится преодолевать высокую устойчивость молекулы N2, вызванную рекордной энергией тройной связи двух атомов азота между собой.
При распаде (диссоциации) молекулы N2 на два отдельных атома азота изменение энергии (энтальпии) составляет 945 кДж/моль (для сравнения, аналогичная величина для кислорода составляет только 498 кДж/моль). Константа скорости реакции распада азота при комнатной температуре исключительно мала, имея порядок около 10−120. В результате даже при температуре в несколько тысяч градусов степень термической диссоциации молекулярного азота составляет лишь доли процента.
В шаге от голода: метод Габера — Боша
В период индустриальной революции XIX века мир столкнулся с острой нехваткой азотных соединений. Экспоненциальный рост промышленности привел к многократному скачку спроса на сырье для красителей, лекарств и взрывчатых веществ. Но особенно острой стала ситуация в мировом сельском хозяйстве: для повышения урожайности требовалось все больше азотных удобрений.
Масштаб природного круговорота азота перестал удовлетворять потребности человечества. А запасы чилийской селитры — минерального источника большей части соединений азота того времени — стали истощаться уже к началу XX века.В июне 1898 года британский химик и будущий президент Лондонского Королевского общества Уильям Крукс выступил в Бристоле с речью перед Британской ассоциацией развития науки. В своем выступлении Крукс объяснил, что через два десятилетия спрос на соединения азота намного превысит их предложение. С помощью несложных расчетов он показал, что миру грозил голод беспрецедентного масштаба. Выступление британца вызвало отклик как у специалистов, так и у мировой прессы. И многие исследователи занялись данной проблемой.
13 октября 1908 года немецкий химик Фриц Габер обратился в патентное ведомство Германской империи с просьбой о защите изобретенного им «способа синтетического получения аммиака из элементов». Метод предполагал простейший из возможных синтезов NH3: прямую газофазную ассоциацию N2 и H2. Однако, для реакции требовались жесткие условия — только высокая температура в сочетании с очень высоким давлением позволяли добиться приемлемого количества продукта.
Патент за номером 235421 был выдан в июне 1911 года и передан компании BASF, где к тому моменту работал изобретатель. Через семь лет Габер стал лауреатом Нобелевской премии по химии (Габер был очень талантливым химиком, но его научный вклад оказался сильно неоднозначным, подробно об его изобретениях можно узнать из статьи М. Молчановой Фриц Габер: человек перед судом истории и из видео на Youtube-канале Veritasium (здесь доступна версия на русском)). Еще через тринадцать лет инженер Карл Бош был удостоен той же награды за разработку уникального для тех лет оборудования, требовавшегося для поддержания температуры и давления в промышленных ректорах синтеза аммиака.
В Советском Союзе первая партия синтетического аммиака с использованием нового для того времен искусственного процесса «азотфиксации» по Габеру — Бошу была получена в 1928 году. В настоящее время мировое производство NH3 превышает 180 миллионов тонн в год и продолжает расти на 3,6% ежегодно. Как и в начале прошлого века, основным применением синтетического аммиака остается производство азотных удобрений для сельского хозяйства.
Аммиак и его недостатки
Метод Габера — Боша, отодвинувший человечество от грани голода, не лишен и ряда недостатков. Столь масштабное производство не может не оказывать влияния на окружающую среду — и влияние это с каждым годом становится все более ощутимым. Высокие температуры и давление, необходимые для синтеза, приводят к колоссальному расходу топлива. Одновременно, необходимый для процесса водород не содержится в атмосфере. Его необходимо получать отдельно, в основном, из природного газа. В наши дни до 5% всего добываемого в мире природного газа расходуется исключительно на синтез аммиака.
Необходимость использования специальных веществ — катализаторов — для облегчения протекания химической реакции в процесса Габера — Боша еще больше усугубляет проблему. При столь высоких температурах катализаторы склонны к спеканию (sintering), а малейшая примесь воды или кислорода в исходном сырье «отравляет» катализатор, лишая его активности.
Осознавая указанные недостатки, химики, физики, инженеры и биологи всего мира на протяжении XX века безуспешно пытались разработать экономически эффективные и, в то же время, менее вредные альтернативы методу Габера — Боша. Эксперименты по поиску альтернативных стратегий фиксации N2 продолжились и в XXI веке. В мире проводились и продолжают реализоваться обширные исследовательские программы, включающие в себя поиск и изучение электрокаталитических, фотокаталитических, биологических и плазменных методов азотфиксации. Но до сих пор данная проблема так и не была решена.
Вода и азот
20 февраля в журнале Nature Communications были опубликованы результаты масштабного проекта трех китайских университетов. В статье Efficient catalyst-free N2 fixation by water radical cations under ambient conditions описан и теоретически обоснован новый плазменный метод фиксации азота с помощью обычной воды.
Если синтез аммиака по методу Габера — Боша основан на каталитическом восстановлении молекулярного азота с помощью водорода, то новый метод предлагает диспропорционирование молекулы N2 без использования катализаторов. Диспропорционирование — окислительно-восстановительный процесс, при котором атомы азота одновременно как окисляются, так и восстанавливаются. Такие реакции часто называют реакциями «самоокисления-самовосстановления» или «дисмутации» — приводя в пример общеизвестное разложение пероксида водорода на воду и кислород. Более современным примером диспропорционирования является метатезис олефинов (olefin metathesis), за реализацию которого Роберт Граббс, Ив Шовен и Ричард Шрок получили Нобелевскую премию в 2005 году.
В случае с азотом в новом исследовании было обнаружено, что диспропорционирование N2 возможно осуществить с помощью водной плазмы. Столь неочевидное на первый взгляд наблюдение стало результатом многолетних усилий трех основных авторов обсуждаемой статьи, направленных на исследование катионов водных кластеров, образующихся в электроспрее. Ведущий автор статьи Хуанвэн Чен (Huanwen Chen), и двое его российских коллег, Константин Чингин и Роман Балабин, впервые заинтересовались непростой химией заряженной воды еще в 2008 году, когда все трое работали в лаборатории органической химии в Швейцарском федеральном технологическом институте в Цюрихе. С тех пор они продолжали изучать необычные процессы, которые протекают как в ионизованных микро- и нанокаплях, так и в нейтральных водных кластерах. С помощью экспериментальных и теоретических методов ими с коллегами были исследованы реакции воды с бензолом, ацетоном, этилацетатом и диметилдисульфидом, а также — с азотсодержащими аминокислотами, глицином и аланином.
Но даже в этом списке крайне инертный молекулярный азот занимает особое место. Необычность наблюдавшихся результатов привела к тому, что их осмысление и теоретическое описание заняли несколько лет. Точнее, реакция азота с водой не поддавалась объяснению в течение двух лет — пока квантово-химическими методами не был выявлен весьма «экзотический» механизм данного химического превращения. По заказу редакции Nature краткая история проекта была описана в отдельной заметке Vitalizing nitrogen: N2 fixation by water radical cations.
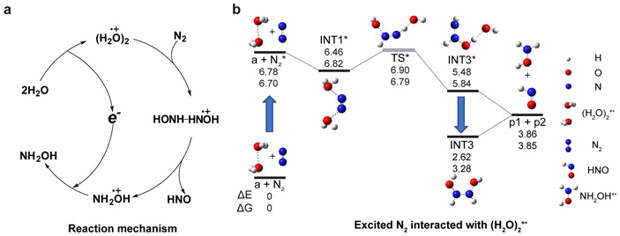
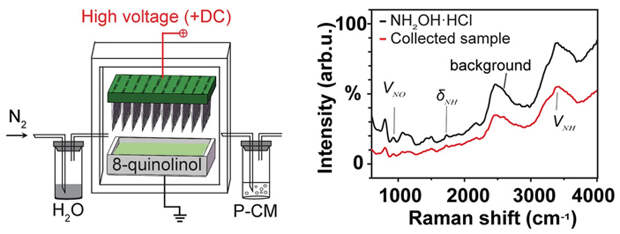
Итоговый механизм нового процесса выглядит следующим образом. На первом этапе на металлические иголки, окруженные парами воды и азотом, подается киловольтное напряжение. В получающемся электрическом разряде образуются катион-радикалы димера воды (H2O)2+ и, одновременно, азот переходит из своего основного инертного состояния в более реакционноспособное возбужденное. Затем электронно-возбужденный азот взаимодействует с катионами (H2O)2+, в результате чего они объединяются в единую химическую систему: образуется весьма необычный промежуточный продукт вида HONH-HNOH+.
На следующем этапе неустойчивый катион HONH-HNOH+ распадается на два конечных продукта, которыми являются нитроксил (азанон, HNO) и гидроксиламин (NH2OH). Первый образуется как нейтральная частица, а второй — как катион. Оба продукта являются формой биологически доступного азота. В новой статье показано, что нитроксил можно использовать для прямого превращения серосодержащей аминокислоты, цистеина, в цистин. Причем степень превращения достигает почти 100% всего за час. Этот эксперимент позволяет предположить, что HNO можно использовать для специфической химической модификации тиолов, являющихся составной частью многих белков.
Гидроксиламин, в свою очередь, можно легко превращать в аммиак, используя для этого обычную электролитическую ячейку, работающую на солнечных батареях. NH2OH можно использовать и напрямую: к примеру, в органическом синтезе из него получают аминокислоты (глицин), а в фарминдустрии он позволяет получать сырье для лекарственных препаратов (анилин). Полимерная промышленность также активно применяет гидроксиламин как ключевой реагент в производстве капрона (нейлона-6).
В отличие от процесса Габера — Боша, новый метод связывания азота можно реализовывать при комнатной температуре и атмосферном давлении, что существенно упрощает требования к химическому оборудованию. Для осуществления дисмутации азота достаточно иметь элементарное разрядное устройство, воду и электричество. Основным отличием нового метода является весьма необычный состав продуктов реакции. Более ранние работы по плазменной фиксации азота позволяли получать из него только весьма ядовитые оксиды азота, включая и печально известный веселящий газ (N2O). Во многом из-за этого плазменные методы до сих пор и не получили сколь-либо заметного распространения в азотной промышленности.
Итоги и перспективы
В лаборатории Цзянсийского университета уже сейчас функционирует лабораторный химический реактор, основанный на дисмутациии азота водой новым плазменным методом. Он способен производить азотсодержащие вещества стоимостью в сотни долларов на каждый киловатт-час использованной электроэнергии. В дальнейшем исследователи планируют создание более крупного реактора, рассчитанного на связывание азота водой уже в промышленных масштабах. Масштабирование процесса выглядит перспективным проектом, поскольку в установке полностью отсутствуют подвижные части, а весь процесс ведется при атмосферном давлении. Таким образом установка не нуждается ни в специальном вакуумном оборудовании, ни в металлоемких реакторах высокого давления. Предварительные оценки, полученные авторами, показывают, что промышленное внедрение плазменного диспропорционирования азота водой позволит кратно снизить энергоемкость всего процесса азотфиксации. Оно же позволит и полностью исключить использование для «оживления» азота невозобновляемых природных ресурсов, в частности — природного газа.
Источник: Xiaoping Zhang, Rui Su, Jingling Li, Liping Huang, Wenwen Yang, Konstantin Chingin, Roman Balabin, Jingjing Wang, Xinglei Zhang, Weifeng Zhu, Keke Huang, Shouhua Feng & Huanwen Chen. Efficient catalyst-free N2 fixation by water radical cations under ambient conditions // Nature Communications. 2024. DOI: 10.1038/s41467-024-45832-9.
Роман Балабин




Свежие комментарии