Черная субстанция — структура головного мозга, играющая важную роль в регулировании моторики и тонуса мышц. При болезни Паркинсона нейроны черной субстанции гибнут от образования в них патологических агрегатов белка альфа-синуклеина, но до сих пор не до конца понятно, что вызывает их формирование в большинстве случаев. Ученые из Финляндии и Испании предложили смелую гипотезу — возможно, всему виной кишечные бактерии. Сейчас они проводят эксперименты, собирая аргументы в ее пользу. В своей последней работе они кормили крошечных нематод Caenorhabditis elegans бактериями из кишечника пациентов с болезнью Паркинсона — и в «головах» у червей тоже стал накапливаться альфа-синуклеин, а сами черви стали массово умирать. Можно ли считать, что черви заболели полноценным паркинсонизмом, и стоит ли нам опасаться заразиться им?
Болезнь Паркинсона — одно из самых частых нейродегенеративных заболеваний в мире. По распространенности она уступает лишь болезни Альцгеймера. Как и любое нейродегенеративное заболевание, она необратима и от нее пока нет эффективного лечения.
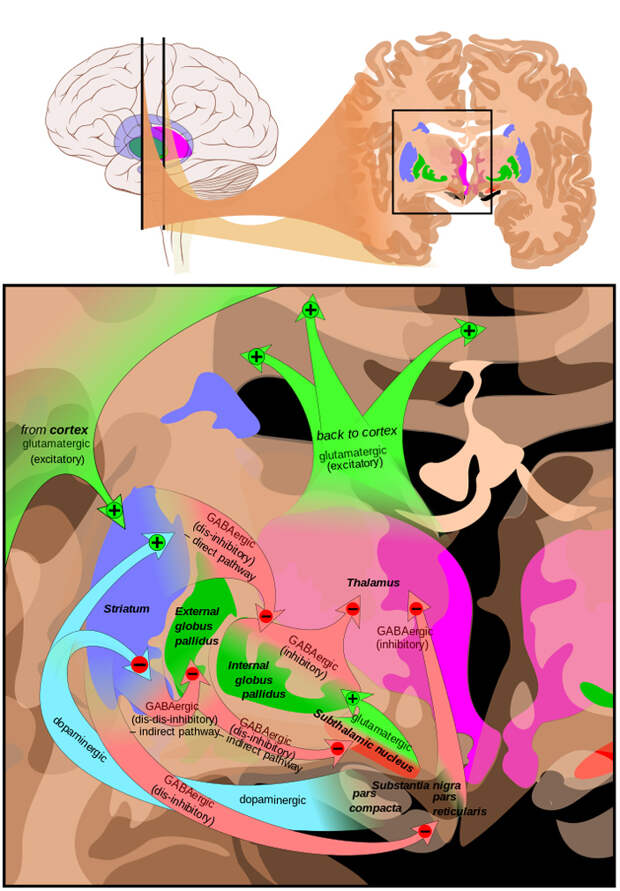
Основным проявлением болезни Паркинсона является затруднение при начале любого двигательного акта (например, ходьбы, письма или речи), которое постепенно прогрессирует: человеку все труднее выполнять привычные ранее действия. Вдобавок это сопровождается тремором (дрожанием мышц) в покое. Такие симптомы вызваны отмиранием нейронов в очень небольшой области головного мозга — так называемой черной субстанции среднего мозга (рис. 1). Находясь в этом древнем отделе ствола мозга, нейроны черной субстанции посылают свои отростки далеко вперед, во внутреннюю часть больших полушарий, где расположена группа ядер, управляющих привычными двигательными актами и неосознанными моторными реакциями (их называют базальными ядрами). Если когда-нибудь вы, идя по скользкой дороге зимой, поскользнулись, но машинально сгруппировались и не упали, — скажите спасибо этой группе ядер.
Человеку, страдающему болезнью Паркинсона, такие сложные рефлексы уже недоступны даже в дебюте заболевания, — а со временем он окажется почти полностью обездвиженным и столкнется с высоким риском инфекционных осложнений (от которых чаще всего такие пациенты и умирают).Тянущиеся через два отдела мозга отростки нейронов черной субстанции образуют синапсы с нейронами полосатого тела — одного из базальных ядер — и снабжают их нейромедиатором дофамином (рис. 2). Когда нейроны черной субстанции отмирают, полосатое тело постепенно лишается дофамина и теряет способность полноценно выполнять свои функции.
На сегодняшний день считается, что гибель нейронов черной субстанции связана с патологическим отложением в них белка альфа-синуклеина, образующего амилоидные агрегаты. В этом состоит сходство патогенеза болезни Паркинсона и болезни Альцгеймера, при которой нейроны тоже погибают от амилоида — правда, от другого. И, хотя недавно стараниями не очень добросовестного нейробиолога Сильвена Лесне амилоидной теории был нанесен удар (см. В статьях о механизме развития болезни Альцгеймера обнаружены систематические фальсификации, «Элементы», 17.09.2022), в ее пользу есть еще слишком много аргументов, поэтому отказываться от нее рано.
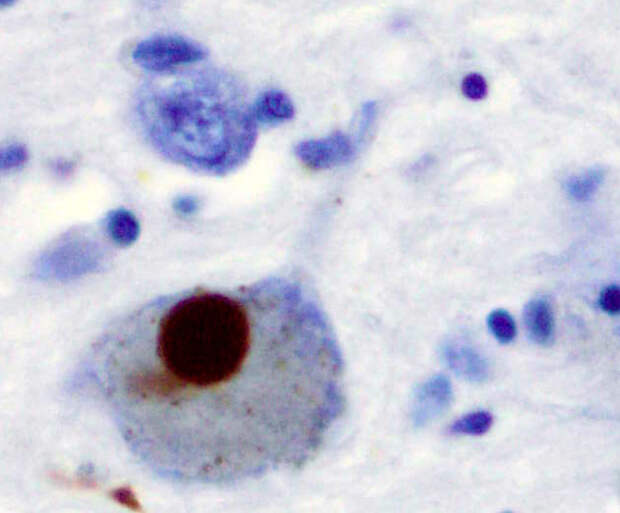
Самым весомым свидетельством в пользу роли альфа-синуклеина в развитии болезни Паркинсона являются естественным образом встречающиеся мутации в его гене, которые приводят к наследственным формам этой болезни с ранним началом. Но у подавляющего большинства больных такие губительные мутации отсутствуют — и тем не менее, альфа-синуклеин с возрастом начинает откладываться у них в нейронах черной субстанции амилоидными клубками, называемыми тельцами Леви (рис. 3). А у них самих развивается клиника этого заболевания.
Возникает вопрос: а что же заставляет альфа-синуклеин образовывать амилоидные агрегаты, если структура белка не изменена мутацией? Недавно группа исследователей из Финляндии и Италии проверила в эксперименте интересную гипотезу. Согласно их данным, этой неизвестной причиной могут быть... кишечные бактерии. На эту мысль их навел тот факт, что агрегаты альфа-синуклеина могут образовываться не только в мозге, но и в эндокринных клетках кишечника, откуда они далее переносятся в мозг по блуждающему нерву — как прионы (R. Chandra et al., 2017. α-Synuclein in gut endocrine cells and its implications for Parkinson’s disease).
Кстати, вирус бешенства переносится от места укуса в мозг точно таким же способом — только нерв уже, конечно, не блуждающий, а один из спинномозговых. Или, если укус пришелся в лицо или шею, — черепных. Тогда прогноз хуже всего, так как по черепным нервам дорога до мозга короче всего, и вакцинация проводится в стационаре. И помимо вакцины придется получить также антирабический иммуноглобулин.
Кроме того, одна бактерия уже продемонстрировала способность запускать агрегацию альфа-синуклеина — и это, как ни странно, кишечная палочка (T. R. Sampson et al., 2020. A gut bacterial amyloid promotes α-synuclein aggregation and motor impairment in mice). Антибиотики, конечно, для ее тотального изничтожения пить не надо — речь идет только о штаммах, вырабатывающих амилоидный белок карлин, основная функция которого и стоит в образовании отложений. Для бактерии это просто часть ее внеклеточного матрикса, но в кишечнике, видимо, он способен запускать агрегацию альфа-синуклеина, будучи для него чем-то вроде ядра кристаллизации. Правда, доказательств связи кишечной палочки и болезни Паркинсона у людей так и не было найдено. Да и мышам для достижения такого эффекта пришлось методом генной инженерии подсаживать человеческий ген альфа-синуклеина.
Зато такая связь была обнаружена для других бактерий — представителей рода Desulfovibrio (K. E. Murros et al., 2021. Desulfovibrio Bacteria Are Associated With Parkinson’s Disease). И именно обнаружившие ее исследователи недавно выпустили новую статью, о которой пойдет речь ниже.
В ней они фактически повторили упоминавшийся выше эксперимент с мышами и продуцирующими карлин кишечными палочками — только с бактериями Desulfovibrio и более простым объектом — нематодой Caenorhabditis elegans. Достоинством этой нематоды, помимо весьма небольшого размера и четко определенного расположения клеток, является ее прозрачность — поэтому, если к «подсаженному» гену альфа-синуклеина присоединить ген желтого флуоресцентного белка, то агрегаты альфа-синуклеина в тканях червя будут светиться. Удобный объект.
Правда, в отличие от экспериментов с кишечной палочкой, в обсуждаемой работе было непонятно, какой именно штамм Desulfovibrio брать. Исследователи решили эту проблему, выделив представителей Desulfovibrio из кишечника пациентов с болезнью Паркинсона и «скормив» их нематодам. Другой группе нематод «достались» бактерии того же рода, но из кишечника здоровых добровольцев. Были и две контрольные группы: одной «скормили» обычную кишечную палочку, другой — карлин-продуцирующую.
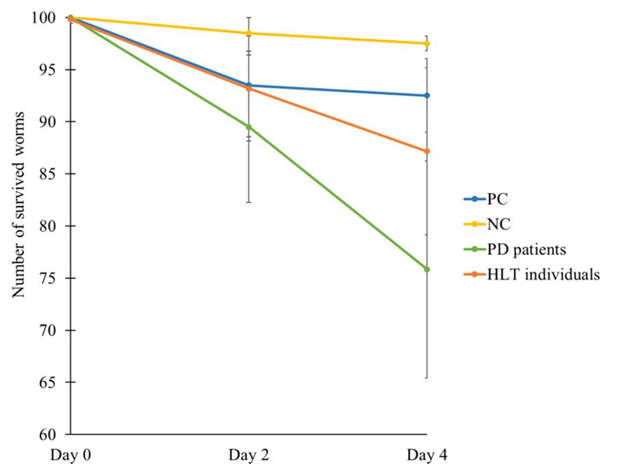
В опытной группе смертность среди червей спустя 4 дня эксперимента оказалась в 8–10 раз выше, чем в контрольной группе, получившей безвредную кишечную палочку. И в ~4 раза выше, чем в группе, которую накормили кишечной палочкой, продуцирующей карлин! Штаммы Desulfovibrio, которые обитали в кишечнике пациентов с болезнью Паркинсона, оказались для червей чем-то вроде чумы, превзойдя даже положительный контроль (рис. 4).
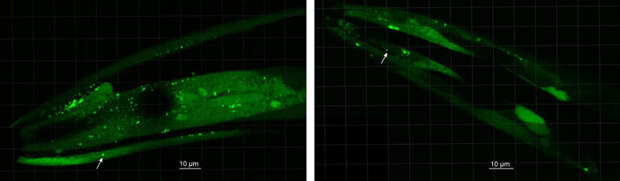
И самое интересное — эти штаммы действительно индуцировали появление амилоидных отложений в головном конце червя, которые были хорошо заметны при флуоресцентной микроскопии. Отложений было гораздо больше, чем у червей, получивших представителей Desulfovibrio от здоровых людей (рис. 5). В общем, бактерии Desulfovibrio (подходящего штамма) индуцируют отложения альфа-синуклеина в тканях нематод и убивают их — а это уже чем-то похоже на болезнь Паркинсона. Вероятно, что эти бактерии так же воздействуют на своих человеческих хозяев.
Здесь начинаются вопросы — на многие из которых еще нет ответы. В обсуждаемой статье авторы отметили формирование отложений альфа-синуклеина в «голове» червя — а в голове у него действительно находится скопление ганглиев, напоминающее мозг. Но в этой экспериментальной модели альфа-синуклеин откладывался вовсе не в «мозге». Как сообщил «Элементам» один из соавторов Пер-Эрик Сарис (Per-Erik Saris), у нематоды альфа-синуклеин откладывается в мышцах головного конца, и тем самым нематода сильно отличается от человека. Но все-таки какие-то предварительные выводы из такого эксперимента сделать можно. «Существуют другие животные модели болезни Паркинсона, больше напоминающие человека, например, мыши,» — отметил он. — «Агенты, вызывающие агрегацию альфа-синуклеина у червя, также всегда вызывали агрегацию альфа-синуклеина на мышиной модели. Мы продолжаем эксперименты с целью анализа эффекта кормления модельных мышей штаммами Desulfovibrio от пациентов с болезнью Паркинсона».
Недостаток нематоды еще и в том, что на ней нельзя проследить нарушение двигательных функций (а вот на дрозофиле, например, можно — дрозофилы с мутантным геном альфа-синуклеина имеют вполне себе «паркинсонический» фенотип, см. M. B. Feany, W. W. Bender, 2000. A Drosophila model of Parkinson's disease). Пер-Эрик Сарис надеется также увидеть вызванное Desulfovibrio нарушение двигательных функций у мышей — в будущих экспериментах.
Также пока неизвестен механизм, посредством которого Desulfovibrio запускает агрегацию альфа-синуклеина в кишечнике пациента или модельного животного. Авторы предполагают, что виной этому может быть вырабатываемый этими бактериями минерал магнетит — но, как отмечает Сарис, у них пока нет данных, что исследованные ими штаммы его вырабатывают. Причиной может быть и сероводород, который выделяют Desulfovibrio — он в высоких концентрациях токсичен для клеток кишечника и, возможно, как-то способствует образованию патогенных белковых агрегатов. Для выяснения этого вопроса авторы тоже собираются провести дополнительные исследования. «Наши результаты могут быть прорывом в понимании, как заболевание может возникать, но необходимо гораздо больше экспериментов — особенно до того момента, когда наши результаты начнут помогать пациентам с болезнью Паркинсона,» — отмечает Сарис.
До получения новых результатов не имеет смысла и каким-то образом стараться избегать встречи с опасными бактериями — возможно, это просто невозможно и они живут внутри всех нас. «Возможно, мы каждый день едим бактерий Desulfovibrio в очень малых количествах. На данном этапе мы не знаем, откуда берутся потенциально патогенные штаммы, выделенные от пациентов, страдающих болезнью Паркинсона,» — считает Сарис.
Наконец, вполне вероятно, что бактерии — это не самый опасный фактор риска болезни Паркинсона, подстерегающий нас в окружающей среде. Возможно, куда опаснее пестициды и другие химические загрязнители. Спустя две недели после публикации статьи Сариса и коллег в журнале Nature Communications вышла статья о том, что десятки широко используемых в сельском хозяйстве пестицидов ассоциированы со случаями болезни Паркинсона и токсичны для нейронов, вырабатывающих дофамин. И это тоже кажется очень вероятным, учитывая, что самые простые и старые животные модели болезни Паркинсона предполагают воздействие именно химических агентов. Так что многофакторность этого заболевания заставляет не только присматриваться к бактериям, но и обращать внимание на экологическую безопасность.
Источник: Vy A. Huynh, Timo M. Takala, Kari E. Murros, Bidhi Diwedi and Per E. J. Saris. Desulfovibrio bacteria enhance alpha-synuclein aggregation in a Caenorhabditis elegans model of Parkinson’s disease // Frontiers in Cellular and Infection Microbiology. 2023. DOI: 10.3389/fcimb.2023.1181315.
Георгий Куракин

Свежие комментарии