
Поляков Алексей Сергеевич, к.м.н., начальник гематологического отделения клиники кафедры факультетской терапии, нештатный главный гематолог ВМедА им. С.М.Кирова
Анемия относится к числу наиболее частых находок в рутинной клинической практике терапевтов, кардиологов, нефрологов, гастроэнтерологов, акушеров-гинекологов и врачей многих других специальностей.
В наши дни диагностика и терапия анемии представляют собой, в большинстве случаев, не гематологическую, а общемедицинскую задачу. От того, насколько рано специалист любого профиля заподозрит анемию, правильно интерпретирует лабораторные показатели и выберет обоснованную тактику, напрямую зависят объем дальнейшего обследования пациента, прогноз и качество его жизни.Именно практическому взгляду на анемии посвящена лекция «Анемия в практике врачей различных специальностей», которую представил Алексей Сергеевич Поляков, кандидат медицинских наук, начальник гематологического отделения клиники кафедры факультетской терапии, нештатный главный гематолог ВМедА им. С.М. Кирова. В своем выступлении доктор Поляков сосредоточился на возможностях лечения анемий, связанных с дефицитом микронутриентов и, особенно, с дефицитом железа, а также подробно остановился на типичных сложностях применения утвержденных клинических рекомендаций в реальной работе врача.
В начале лекции Алексей Сергеевич напомнил, что, согласно определению Всемирной организации здравоохранения, анемия рассматривается как клинико-гематологический синдром, который характеризуется снижением содержания гемоглобина в единице объема крови ниже 130 г/л у мужчин и ниже 120 г/л у небеременных женщин, для беременных используется порог 110 г/л [1, 2].
У детей критерии зависят от возраста, однако принцип остается тем же: снижение уровня гемоглобина отражает нарушение баланса между образованием эритроцитов и их потерей или разрушением [1, 2]. Нормативы ВОЗ были предложены более полувека назад, однако исследования последних десятилетий подтверждают, что именно на этих границах начинают нарастать клинические риски, и потому пороговые значения по-прежнему считаются обоснованными. 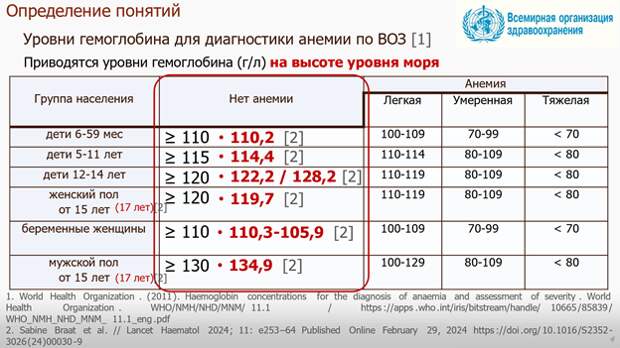
Отдельный акцент был сделан на том, что анемию важно понимать не только как «малокровие» в прямом смысле, когда снижается общее количество гемоглобина в организме из-за недостаточного кроветворения или хронической кровопотери [3]. Существует и другая ситуация, когда лабораторно фиксируется снижение концентрации гемоглобина в единице объема крови при сохранном количестве эритроцитов. Это так называемая «разбавительная» анемия, которая формируется на фоне гидремии при беременности, хронической сердечной недостаточности, остром или хроническом повреждении почек [3]. В таком случае объем плазмы возрастает быстрее, чем успевает адаптироваться эритрон, и врач видит снижение гемоглобина без истинного дефицита красной крови. Данный феномен следует иметь в виду во избежание гипердиагностики и выбора неверной терапевтической стратегии.
Клиника и классификация анемий
Клинические проявления анемии объединяют в понятие анемического синдрома, симптомы которого разнообразны и неспецифичны [3, 4]. Врач чаще всего видит перед собой пациента с жалобами на слабость, повышенную утомляемость, снижение переносимости привычных нагрузок. Нередко также при анемии отмечается прогрессирование симптомов хронических сердечно-сосудистых, легочных и других заболеваний, при этом неспецифичные симптомы легко маскируются под картину основного заболевания, и анемия остается недооцененной находкой в общем анализе крови. Алексей Сергеевич отдельно подчеркнул парадокс анемии: организм адаптируется к постепенному снижению уровня гемоглобина, поэтому тяжесть клинических симптомов не всегда коррелирует с глубиной анемии. Симптоматика может полностью отсутствовать даже при тяжелой анемии у большинства пациентов с медленно развивающейся анемией.
Современная патогенетическая классификация анемий строится вокруг ключевого вопроса о том, на каком уровне нарушен путь эритроцита от стволовой клетки до его разрушения. Первый большой блок составляют анемии, связанные с нарушениями эритропоэза (апластическая анемия, В12-, фолиево- и железодефицитные анемии, а также анемии хронических состояний, при которых нарушается доступность железа и регуляция эритропоэза), второй – анемии вследствие кровопотери и преждевременного разрушения эритроцитов (в том числе постгеморрагическая, связанная с дефицитом железа) [5]. Таким образом, в данном контексте железодефицитная анемия (ЖДА) является полиэтиологическим, полипатогенетическим состоянием и не поддается строгой классификации.
Гораздо большее значение для повседневной практики имеет не патогенетическая, а так называемая рабочая (организационная) классификация анемий [4, 6].
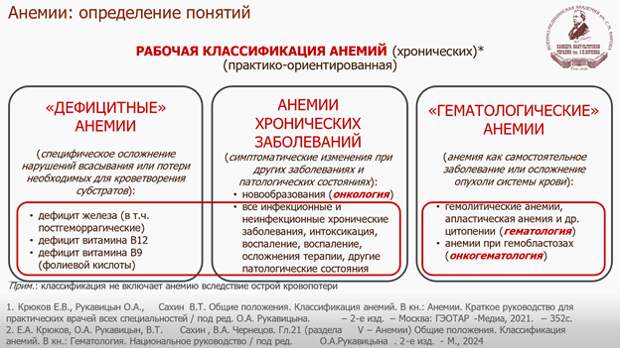
Такой взгляд сразу показывает, что только небольшая часть анемий действительно относится к сфере компетенций гематологов и онкогематологов. К этой группе можно отнести гемолитические анемии, апластическую анемию и другие цитопении, анемии при гемобластозах. Основной массив случаев составляют дефицитные анемии и анемии хронических состояний, которые являются междисциплинарной зоной ответственности, где главную роль играют врачи первичного звена и специалисты соматического профиля.
Эта логика закреплена в действующем порядке оказания медицинской помощи по профилю «гематология», утвержденном приказом МЗ РФ от 15 ноября 2012 г. № 930н [7]. В документе подчеркнуто, что первичная специализированная медико-санитарная помощь оказывается врачом-гематологом, однако, ведение пациентов с железодефицитной анемией и другими анемиями, связанными с питанием, а также с острой постгеморрагической анемией, с анемией при хронических заболеваниях и рядом других вариантов может проводиться на уровне врача-терапевта и врача-педиатра [7]. Нормативная база тем самым подтверждает, что эти формы анемий не должны автоматически служить поводом отправлять пациента к гематологу, а могут и должны вестись в общемедицинской практике. Кроме того, Клинические рекомендации по анемиям, связанным с питанием, адресованы сразу нескольким категориям специалистов, включая врачей-гематологов, терапевтов, педиатров, хирургов, акушеров-гинекологов, онкологов, гастроэнтерологов и гериатров, что подтверждает их право не только диагностировать, но и лечить железодефицитную, фолиево- и В12-дефицитную анемии [8-12]. Данная практика уже широко используется в стране. Согласно стандартам оказания медицинской помощи РФ [13, 14], которые, по сути, отражают результаты уже сложившейся клинической практики и позволяют судить о том, как в среднем устроена маршрутизация пациентов, только около 5% больных с анемиями попадает на прием к гематологу. Это означает, что 95% случаев успешно ведутся врачами других специальностей.
Постгеморрагические анемии
Острая постгеморрагическая анемия занимает особое место среди других форм анемий, поскольку в ее основе лежит не постепенное нарушение кроветворения, а одномоментная или кратковременная утрата значительного объема циркулирующей крови. Острая кровопотеря рассматривается как патологическое состояние, которое развивается при наружном или внутреннем кровотечении, кровоизлиянии в полости тела или мягкие ткани, а также при ряде других процессов, например при гемолизе или тромбообразовании [15, 16]. При этом снижение гемоглобина или появление симптомов анемического синдрома не является обязательным критерием самой кровопотери.
Снижение объема циркулирующей крови на 10% и более, сопровождающееся снижением гемоглобина ниже диагностических порогов (
С практической точки зрения важно помнить, что снижение гемоглобина при острой кровопотере выявляется не сразу, а только через 1-2 дня [17, 18]. Активация эритропоэза приводит к восстановлению показателей крови через 4-5 дней [17, 18]. Важно учитывать, однако, что усиленная работа костного мозга и ускоренное восстановление эритронного пула требуют значительного расхода железа, витамина В12, фолиевой кислоты и других микронутриентов. Если исходные запасы были ограниченными или у пациента есть хронические потери и нарушения питания, через несколько недель или месяцев после эпизода кровопотери может сформироваться вторичная дефицитная анемия. В отдельных случаях этот интервал растягивается на годы, и тогда врачу приходится последовательно исключать другие причины анемии, прежде чем удается связать ее с давним эпизодом кровопотери.
Дефицитные анемии
Анемии, связанные с дефицитом микронутриентов, относятся к группе вторичных (симптоматических) анемий. Они формируются при недостаточном поступлении с пищей или при избыточной потере необходимых для кроветворения субстратов, прежде всего железа, витамина В12 и фолиевой кислоты [17].
Мегалобластные анемии при дефиците витамина В12 и фолиевой кислоты по своей сути представляют собой не самостоятельное заболевание, а осложнение большого круга патологических состояний, связанных с:
- недостаточным поступлением В12/В9 с пищей (мальнутриция);
- нарушением пищеварения (мальабсорбция);
- кровопотерей (увеличение потребности в нутриентах при восстановлении);
- повышением потребности в нутриентах (В12/В9): беременность и лактация; быстрый рост (недоношенность, подростки); интенсификация физической активности, новообразования [9, 10, 19, 20].
Железодефицитная анемия также является хроническим осложнением различных патологических и даже физиологических процессов [8, 19, 20]. Патогенетически железодефицитная анемия формируется при недостаточном поступлении железа с пищей, и/или нарушениях пищеварения, и/или связана с повышением потребности в железе и/или с кровопотерей (в том числе менструальной, у женщин репродуктивного возраста) [8, 19, 20]. Алгоритм выявления причины железодефицитного состояния включает последовательное исключение всех причин, потенциально стоящих за развитием патологии.
Лектор отметил, что говорить о балансе железа в организме, когда поступление и траты микронутриента примерно одинаковы, можно только в контексте мужского пола. У мужчин поступление железа с пищей и его потери примерно совпадают и составляют около 1-2 мг в сутки [21]. При этом совокупный запас железа в мужском организме выше, чем у женщин, а исходное содержание железа на 30-50% больше.
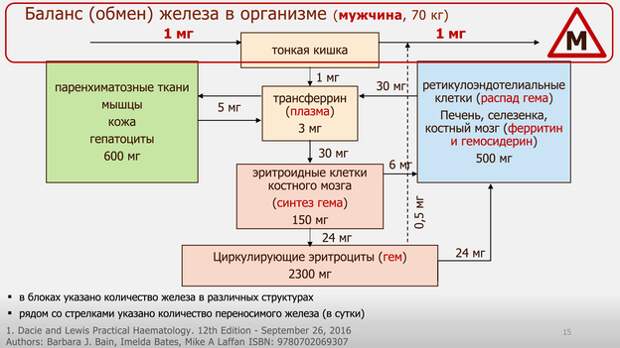
У женщин репродуктивного возраста даже вне беременности, родов и лактации картина принципиально иная [22, 23]. Регулярная физиологическая менструальная кровопотеря накладывается на изначально меньший объем запасов железа. Дополнительная потеря около 1 мг железа в сутки (что соответствует примерно 30 мг за менструацию и приблизительно 60 мл крови), еще может быть компенсирована и считается физиологическим пределом. Однако нормальная по гинекологическим критериям менструальная кровопотеря достигает 80 мл за цикл и означает утрату до 40 мг железа. В среднем менструирующие женщины теряют дополнительно около 1,75 мг железа в сутки [22].
Беременность еще более нарушает баланс железа [23]. В течение беременности дополнительные потери железа в среднем составляют около 3,7 мг. За один физиологический гестационный цикл с последующей лактацией, даже без учета родовой кровопотери, суммарный дефицит железа достигает 1,5-2 грамм.
Физиологическое поступление железа с пищей на фоне стандартной «европейской» диеты обычно не превышает 12-14 мг в сутки, при этом всасывается не более 15% поступившего железа. С учетом менструальных кровопотерь неудивительно, что по меньшей мере 50-60% женщин репродуктивного возраста сталкиваются с латентным дефицитом железа или явной железодефицитной анемией. Для поддержания баланса вне беременности и лактации требуется прием не менее 18 мг железа в сутки с пищей, что далеко не всегда достигается в реальной жизни [24].
Лектор подчеркнул, что данная статистика касается именно здоровых женщин, что формирует своеобразный парадокс. С одной стороны, определение обильной менструальной кровопотери трактует ее как чрезмерную менструальную кровопотерю, которая влияет на физическое, социальное, эмоциональное или материальное благополучие женщины [25, 26]. С другой стороны, ВОЗ определяет здоровье как состояние полного физического, душевного и социального благополучия, а не только отсутствие болезней. Если исходить из этих формулировок, типичная менструирующая женщина с хроническим дефицитом железа, усталостью и снижением работоспособности формально уже не укладывается в понятие здорового человека, даже при отсутствии явной болезни в привычном понимании.
У мужчин, в отличие от женщин, физиологической кровопотери быть не может. На практике наиболее частыми причинами железодефицита у мужчин оказываются кровопотери из желудочно-кишечного тракта, включая хронический геморрой, а также травмы, ранения, повторяющиеся носовые кровотечения, осложнения нарушений системы гемостаза [8]. Существенную роль играют заболевания желудочно-кишечного тракта, которые одновременно ухудшают всасывание железа и увеличивают его потери. Дополнительно возможна ситуация повышенной потребности в железе при интенсивном росте, высокой физической нагрузке, восстановлении после тяжелых заболеваний, при новообразованиях [8]. Опухолевый процесс лектор выделил отдельно и подчеркнул, что у мужчин с железодефицитной анемией он является частой причиной, которую необходимо активно искать и целенаправленно исключать.
Возможности диагностики анемий
В повседневной практике дифференциальная диагностика анемий в первую очередь опирается на эритроцитарные индексы – показатели, фигурирующие в любом общем анализе крови [19, 27]. Оценка среднего содержания гемоглобина в эритроците (MCH) указывает на гипохромные, нормохромные и гиперхромные варианты, а среднего объема эритроцитов (MCV) – на микроцитарные, нормоцитарные или макроцитарные анемии [19, 27]. Уже на этом этапе формируется первичное представление о вероятной природе анемии и выстраивается диагностический алгоритм.

Выявление гипохромии и микроцитоза позволяет предположить либо железодефицитную анемию, либо анемию хронических заболеваний. Ключевым маркером для их различения становится уровень ферритина сыворотки. Пониженный ферритин говорит в пользу ЖДА, а нормальный или повышенный заставляет думать об анемии хронических заболеваний [19, 27]. Алексей Сергеевич обратил внимание на то, что у женщин дефицит железа нередко сопровождается тромбоцитозом, особенно в период менструации или сразу после нее, а также лейкопенией за счет нейтропении, которая отражает нарушение кроветворения. Если абсолютный дефицит железа не подтверждается, поиск причин смещается в сторону хронических заболеваний и хронических состояний с постепенным расширением спектра обследования.
Нормохромная нормоцитарная анемия также редко свидетельствует о состояниях, требующих вмешательства гематолога. В первую очередь необходимо исключить анемии, связанные с дефицитом микронутриентов, оценив запасы железа, уровень фолиевой кислоты и витамина В12. Если исследование ферритина сыворотки показывает его снижение, речь идет о скрытом дефиците железа. Подключение гематолога возможно при подозрении на наследственные гемолитические анемии.
Гиперхромные макроцитарные анемии в подавляющем большинстве случаев связаны с дефицитом витамина В12 и фолиевой кислоты. Нередко они сочетаются с тромбоцитопенией, нейтропенией и лабораторными признаками гемолиза. Диагностический алгоритм в этой ситуации обязательно включает определение числа ретикулоцитов, что позволяет понять, какой характер носит анемия – гипо-или гиперрегенераторный. Повышенное количество ретикулоцитов заставляет думать о кровопотере или о патологии почек, в том числе онкологической. Признаки гемолиза удобнее всего отслеживать по уровню лактатдегидрогеназы, который является гораздо более чувствительным маркером, чем непрямой билирубин или увеличение селезенки. Пониженное количество ретикулоцитов ориентирует врача в сторону поражения печени, злоупотребления алкоголем, гипотиреоза, хронической почечной патологии.
После того как наиболее частые и очевидные причины анемии исключены или подтверждены, пациента при необходимости можно направлять к гематологу. Однако в реальной практике большинство пациентов может быть доведено до окончательного диагноза без участия гематолога и без цитологического исследования костного мозга. Грамотное использование общедоступных лабораторных показателей позволяет врачу любой специальности выстроить логичную диагностическую цепочку и прийти к обоснованному заключению о природе анемии.
Железодефицитная анемия (ЖДА)
Самым распространенным вариантом анемии в общей практике остается железодефицитная анемия [8]. Среди женщин репродуктивного возраста в России по данным 2023 г. она выявляется в 24,9% случаев. По собственным наблюдениям лектора реальная распространенность ЖДА в этой группе может достигать 60%. Клиническая картина железодефицитной анемии и предшествующей ей стадии латентного дефицита железа определяется сидеропеническим синдромом, проявления которого включают [8]:
- изменения кожи (пигментации цвета кофе с молоком) и слизистых оболочек (заеды в углу рта);
- изменения ногтей (ломкость, мягкость, поперечная исчерченность, вогнутость — койлонихии);
- изменения волос (ломкость, тусклость, раздваивание кончиков, алопеция);
- изменения обоняния (пристрастие к запахам лака, красок, ацетона, выхлопных газов автомобиля);
- изменения вкуса (пристрастие к мелу, глине, сырым продуктам);
- гипотония (мышечная, артериальная).
С лабораторной точки зрения, наиболее чувствительным и специфичным параметром железодефицита является снижение ферритина сыворотки ниже 30-45 нг/мл при отсутствии других причин (возраста старше 65 лет, хронических заболеваний и острых воспалительных состояний). Другим важным показателем является коэффициент насыщения трансферрина железом [8]. Значения ниже 17,8-20% также указывают на дефицит железа. Другие параметры, например растворимые рецепторы трансферрина (более 4-5 мг/л), уровень гепцидина (менее 1,49 нг/мл) и т.д., пока мало доступны, не имеют отработанного прикладного значения и не доказали значимость для повседневной клинической практики.
Основным ориентиром для врача по-прежнему остаются клинические рекомендации по диагностике и лечению железодефицитной анемии [8]. При этом Алексей Сергеевич обратил внимание на принципиальные спорные моменты, главный из которых касается «нормы» ферритина. В действующих рекомендациях приводится широкий интервал референсных значений от 11 до 306 нг/мл, но при формальном следовании этим рамкам диагноз дефицита железа поставить трудно. Например, молодая женщина с гипохромией и микроцитозом, низким, но формально нормальным ферритином и жалобами на хроническую усталость оказывается вне зоны активных действий врача. Пациентку фактически приходится отпускать без лечения и наблюдать, пока через несколько месяцев не сформируется развернутая железодефицитная анемия.
В качестве демонстрации такой ситуации доктор Поляков привел следующий клинический пример:

Такая ситуация с размытыми границами нормы в клинических рекомендациях могла возникнуть из-за использования референсных значений ферритина у пациенток без диагностированного дефицита железа, однако, референсная популяция, можно сказать, изначально скомпрометирована в связи с широчайшей распространенностью невыявленного железодефицита. Например, исследование, проведенное доктором Поляковым и его соавторами среди женщин-военнослужащих 18-21 лет, показало, что железодефицитная анемия выявлялась у 23,9-34% молодых женщин, и еще у 35,6-36,7% диагностировался латентный дефицит железа [28, 29].
Лектор напомнил, что понятие нормы в лабораторной диагностике уже давно заменено понятием порога клинического решения [30]. Это числовое значение, которое служит основанием для начала лечебных мероприятий [30]. Исторически диагноз дефицита железа устанавливался на основании исследования костного мозга, и сопоставление морфологической картины с уровнем ферритина в ту эпоху позволило установить порог принятия клинического решения в 30 нг/мл [31-33]. При этом данная цифра отражает уже умеренный дефицит железа в костном мозге и не является нижней границей условной нормы [32]. В гематологическом сообществе принято ориентироваться на условную границу 45 нг/мл для диагностики дефицита железа у взрослых пациентов без выраженной коморбидности [34]. У лиц старше 65 лет, а также у больных с хроническими заболеваниями и острыми воспалительными процессами, клинически значимым считают порог ферритина 100 нг/мл и выше [35-37].
Несмотря на широкий диапазон «нормы» ферритина в клинических рекомендациях, целевые ориентиры терапии сформулированы более реалистично. Цель лечения ЖДА и латентного дефицита железа заключается в восстановлении тканевых запасов железа до уровня ферритина 40-60 нг/мл [8], хотя в реальной практике лектор рекомендует для большинства пациентов ориентироваться на значения 80-100 нг/мл.
Алексей Сергеевич напомнил, что клинические рекомендации не являются нормативно правовыми актами [38] и остаются инструментом, который помогает, но не подменяет клиническое мышление.
В европейских документах подход к диагностике дефицита железа во многом совпадает с обсуждаемой логикой: порогом клинического решения для ферритина считают уровень 30-45 нг/мл, а для группы пациентов старше 65 лет и для больных с острыми воспалительными или хроническими заболеваниями – 100 нг/мл [35].
На основании вышесказанного, в приведенном выше клиническом примере диагноз и рекомендации должны быть скорректированы следующим образом.

Возможности лечения
При большинстве анемий препараты железа остаются одним из ключевых элементов терапии. Это касается не только классической железодефицитной анемии: железо входит в схемы лечения анемий хронических заболеваний, постгеморрагических состояний, мегалобластных анемий и ряда гематологических форм [8, 19, 20].

В России в настоящее время доступно около 45 лекарственных форм железа [39]. Поэтому в задачи врача входит осознанный выбор молекулы, пути введения и режима дозирования с учетом клинической ситуации.
Парентеральные препараты железа позволяют быстро обеспечить потребности кроветворения и восполнить резерв железа, однако, показания к их использованию строго ограничены, а введение возможно только в условиях стационара [8]. Пероральные препараты рассматриваются как предпочтительный вариант для большинства больных [8]. При тяжелых анемиях возможно комбинированное лечение инъекционными и пероральными средствами.
Несмотря на то, что биодоступность парентеральных препаратов железа в среднем значительно превышает биодоступность пероральных форм, отдельные таблетированные средства, содержащие двухвалентное железо в сочетании с аскорбиновой кислотой, приближаются по усвояемости к инъекционным препаратам [40, 41].
Отечественные клинические рекомендации в качестве терапии ЖДА первой линии предлагают пероральные препараты двух- или трехвалентного железа в оптимальной суточной дозе 120 мг элементарного железа (для профилактики – 60 мг) [8]. По мнению гематологов, этого уровня часто оказывается недостаточно для быстрого и выраженного клинического эффекта. Более того, в документе говорится о возможности применения еще более низких доз и приема через день для уменьшения риска побочных эффектов несмотря на то, что эффективность альтернирующих режимов была показана только у пациентов без сформировавшейся ЖДА [8]. Поэтому, как подчеркнул лектор, альтернирующие режимы и низкие дозы корректно рассматривать именно как инструмент профилактики дефицита железа, тогда как для лечения ЖДА требуются более высокие дозы и ежедневный прием.
Так, например, в разбираемом клиническом примере назначение рекомендуемых доз железосодержащих препаратов не оказало значимого клинического эффекта.

В практической работе Алексей Сергеевич предлагает опираться прежде всего на инструкции к конкретным лекарственным препаратам. Инструкция для медицинского применения содержит минимально необходимый и достаточный объем информации для эффективного и безопасного использования, и, с юридической точки зрения, имеет приоритет над клиническими рекомендациями. Например, инструкция к препарату Сорбифер Дурулес, содержащему максимально доступную для перорального введения форму железа в сочетании с аскорбиновой кислотой [41], говорит о том, что обычно рекомендуемой дозой является 2 таб. по 100 мг в сутки, и при необходимости она может быть повышена. При беременности препарат назначается по 1 таб. в день в течение первых 6 мес, и потом 2 таб. в день на 3м триместре и в период грудного вскармливания [41].
Продолжительность терапии дефицита железа определяется индивидуально, но как правило составляет 3-6 и более мес [8]. При этом важно не ограничиваться нормализацией гемоглобина, а продолжать терапию до достижения целевых показателей обмена железа, прежде всего уровня ферритина и коэффициента насыщения трансферрина [8]. Только тогда можно говорить о реальном восполнении депо и снижении риска рецидива.
Для тех, кто опасается назначать дозы выше указанных в клинических рекомендациях, лектор привел исторический пример. В учебной литературе 1947 года [42] описываются схемы, при которых препараты железа назначали практически при всех анемиях в дозах до 10 г в сутки (в форме гидроксида железа в облатках), что не сопровождалось токсическими эффектами. Сегодня на рынке присутствуют гораздо более удобные, эффективные и безопасные препараты, и назначение рациональных терапевтических доз не должно вызывать лишних сомнений.
Возвращаясь к рассматриваемому клиническому случаю, доктор Поляков отметил, что адекватный режим терапии позволил добиться выраженного клинического ответа и достичь компенсации ЖДА и восполнения запасов тканевого железа.

Препарат Сорбифер Дурулес используется в клинической практике более 30 лет и до сих пор остается одной из наиболее взвешенных опций для пероральной терапии дефицита железа. Его состав и лекарственная форма хорошо вписываются в требования ВОЗ к современным препаратам железа [41, 43, 44]:
- Сорбифер Дурулес содержит двухвалентное железо, а также аскорбиновую кислоту, которая повышает всасывание примерно на 30%.
- Максимальная разовая доза 100 мг элементарного железа обеспечивает абсорбцию до 14 мг железа.
- Технология замедленного высвобождения Дурулес обеспечивает постепенное высвобождение ионов железа в просвете кишечника, что улучшает переносимость, снижает частоту гастроинтестинальных побочных эффектов и в то же время поддерживает высокую биодоступность.
Независимые непрямые исследования показывают, что препараты железа на основе двухвалентного железа, в том числе Сорбифер Дурулес, не уступают, а часто превосходят по биодоступности многие формы трехвалентного железа [40]. Для практикующего врача важно, что такая комбинация одновременно эффективна и предсказуема по профилю безопасности, что облегчает длительную терапию и повышает приверженность.
Назначение эффективных доз железосодержащих препаратов позволяет достичь клинического и лабораторного разрешения железодефицитной анемии, что было показано на разбираемом клиническом примере.

В завершение Алексей Сергеевич еще раз подчеркнул, что диагностика и лечение подавляющего большинства анемий остаются общемедицинской задачей и в типичных случаях не требуют участия гематолога. На переднем плане находятся анемии, связанные с дефицитом микронутриентов, и прежде всего с дефицитом железа, который остается самым частым вариантом дефицитарной патологии крови. Понимание механизмов развития дефицита железа и грамотное использование доступных лабораторных маркеров позволяют врачу практически любой специальности своевременно заподозрить железодефицитное состояние, подтвердить его лабораторно еще на стадии латентного дефицита и назначить рациональную терапию препаратами железа. Именно такой подход дает шанс не только предотвратить развернутую железодефицитную анемию, но и реально улучшить качество жизни пациентов, для которых анемия слишком часто остается фоном, а не заявленной клинической проблемой.
Литература:
- World Health Organization. (2011). Haemoglobin concentrations for the diagnosis of anaemia and assessment of severity. World Health Organization. WHO/NMH/NHD/MNM/11.1 / https://apps.who.int/iris/bitstream/handle/10665/85839/ WHO_NMH_NHD_MNM_11.1_eng.pdf
- Sabine Braat et al. // Lancet Haematol 2024; 11: e253–64 Published Online February 29, 2024 https://doi.org/10.1016/S2352-3026(24)00030-9
- Руководство по гематологии: в 3 т. Т.3. Под ред. А.И.Воробева. 3-4 изд. М, 2005 г. – 416 с.
- Крюков Е.В., Рукавицын О.А., Сахин В.Т. Общие положения. Классификация анемий. В кн.: Анемии. Краткое руководство для практических врачей всех специальностей / под ред. О.А. Рукавицына. – 2-е изд. – Москва: ГЭОТАР-Медиа, 2021. – 352с.
- Поляков А.С., Тыренко В.В., Кольцов А.В. Анемии. В кн.: Госпитальная терапия: учебн. для медицинских ВУЗов (готовится к изданию)
- Е.А. Крюков, О.А. Рукавицын, В.Т. Сахин, В.А. Чернецов. Гл.21 (раздела V – Анемии) Общие положения. Классификация анемий. В кн.: Гематология. Национальное руководство / под ред. О.А.Рукавицына. 2-е изд. — М., 2024
- Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 930н «Об утверждении Порядка оказания медицинской помощи населению по профилю»гематология"
- Клинические рекомендации ID:669 Железодефицитная анемия. – 2024, МЗ РФ. — https://cr.minzdrav.gov.ru/
- Клинические рекомендации ID:540 Фолиеводефицитная анемия. – 2023, МЗ РФ. — https://cr.minzdrav.gov.ru/
- Клинические рекомендации ID:536 В12 дефицитная анемия. – 2021, МЗ РФ. — https://cr.minzdrav.gov.ru/
- Клинические рекомендации ID:624 Анемия при ЗНО. – 2024, МЗ РФ. — https://cr.minzdrav.gov.ru/
- Практические рекомендации RUSSCO #3s2, 2022 (том 12). 19–25. DOI: 10.18027/2224-5057-2022-12-3s2-19-25
- Стандарт медицинской помощи детям при железодефицитной анемии (диагностика, лечение и диспансерное наблюдение). Приказ Минздрава России от 13.07.2022 N 487н
- Стандарт медицинской помощи взрослым при железодефицитной анемии (диагностика, лечение и диспансерное наблюдение). Приказ Минздрава России от 04.04.2023 N 138н
- Тыренко В.В., Поляков А.С., Живописцева А.М. Патология системы крови у раненых. В кн.: Военно-полевая терапия: национальное руководство / под ред. Е.В. Крюкова. — 2-е изд., перераб. и доп. — Москва: ГЭОТАР-Медиа, 2024. — 736 с.
- Поляков А.С., Тыренко В.В. Методические рекомендации по этапному лечению пораженных с боевой терапевтической патологией (раздел 7.7 Патология системы крови у раненых) под ред. Д.В. Тришкина. Москва: ГВМУ, 2022 г. – 273 с.
- Крюков Е.В., Поляков А.С., Живописцева А.М., Свинцицкая И.С. Болезни крови и кроветворных органов. В кн.: Военно-полевая терапия: национальное руководство / под ред. Е.В. Крюкова. — Москва: ГЭОТАР-Медиа, 2024. — 736 с.: ил.
- Тыренко В.В. Поляков А.С., Носков Я.А. Кровопотеря и постгеморрагическая анемия. В кн.: Указания по военно-полевой терапии. — М., ГВМУ — 2025 с.
- Шевченко Ю.Л., Новик А.А., Мельниченко В.Я. Анемии (руководство по диагностике и лечению). М.: РАЕН, 2012. – 350с.
- Анемии. Краткое руководство для практических врачей всех специальностей / под ред. О.А. Рукавицына. – 2-е изд. – Москва: ГЭОТАР-Медиа, 2021. – 352с.
- Dacie and Lewis Practical Haematology. 12th Edition — September 26, 2016 Authors: Barbara J. Bain, Imelda Bates, Mike A Laffan ISBN: 9780702069307
- Идельсон Л.И. Обмен железа. В кн.: Руководство по гематологии: в 3 т. Т.3. Под ред. А.И.Воробьева. 3-е изд. М., 2005 г. 416 с.
- Bothwell TH Am J Clin Nutr 2000;72(suppl):257S–64S
- Hallberg, L. et al. «Iron requirements in menstruating women», 1991
- Клинические рекомендации ID:645 Аномальные маточные кровотечения. 2023 г.
- Munro, M. et al. «The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years: 2018 revisions», 2018
- Новик А.А. Богданов А.Н. Анемия (от А до Я). Руководство для врачей — СПб.: Нева, 2004.- 250 с.
- Ковалев А.В., Тишко В.В., Поляков А.С., Главинская А.М., Егорова Е.Н., Буланьков Ю.И. Железодефицитные состояния и повседневная физическая активность у военнослужащих-женщин // Вестник Российской военно-медицинской академии. — 2024. — Т.26, №3. — C. 411-420. doi: 10.17816/brmma623700
- Ковалев А.В., Поляков А.С. Качество жизни при железодефицитных состояниях у женщин молодого возраста // Известия Российской Военно-медицинской академии. 2022. Т. 41. № 2. С. 169–174. DOI: https://doi.org/10.17816/rmmar104651
- ГОСТ Р 53022.3-2008 https://docs.cntd.ru/document/1200072565
- Богданов А.Н. Гематологический атлас / А.Н, Богданов, В.В. Тыренко, Т.С. Зайцева, С.Н. Малахова, Т.Н. Петрова. – СПб.: ВМедА, 2011. – 196 с.: ил. – ISBN 978-5-91322-022-6
- Garcia-Casal MN, Pasricha S-R, Martinez RX, Lopez-Perez L, Peña-Rosas JP. Serum or plasma ferritin concentration as an index of iron deficiency and overload. Cochrane Database of Systematic Reviews 2021, Issue 5. Art. No.: CD011817. DOI: 10.1002/14651858.CD011817.pub2.
- Koca E. et al. «Bone Marrow Iron Staining is a Reliable Test for Elimination of IDA Rather than its Diagnosis», 2013.
- Ko, C.W. AGA Clinical Practice Guidelines on the Gastrointestinal Evaluation of Iron Deficiency Anemia / C.W. Ko, Sh.M. Siddique, A. Patel [et al.] // 2020. — Vol. 159, №3. — P. 1085–1094
- Recommendations for diagnosis, treatment, and prevention of iron deficiency and iron deficiency anemia. 15 July 2024 https://doi.org/10.1002/hem3.108
- Мареев В.Ю. и соавт. Кардиология. 2020;60(1):99-106]. DOI: 10.18087/cardio.2020.1.n961 / Кардиология. 2018;58(6S):8-158]. DOI:10.18087/cardio.2475 / Кардиология. 2021;61(4). DOI: 10.18087/cardio.2021.4.n1639
- 2016 Guidelines for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) and Heart Failure Association (HFA) of the ESC. European Heart Journal. 2016;37(27):2129–200. DOI: 10.1093/eurheartj/ehw128
- Письмо МЗ РФ от 21 января 2025 года № 17-1/3003770-2772 «О применении клинических рекомендацийй»
- https://grls.minzdrav.gov.ru/GRLS.aspx?RegNumber=&MnnR=Железа&lf=&TradeNmR=&OwnerName=&MnfOrg=&MnfOrgCountry=&isfs=0®type=1%2c6&pageSize=10&order=Registered&orderType=desc&pageNum=5&token=139aa6db-9b4b-49c0-9f9d-40f3bdcd8e85 (дата обращения 11.11.2025)
- Nielsen P. Diagnostik und Therapie von Eisenmangel mit und ohne Anämie. Uni-Med-Verlag,. Bremen, 2009.
- Инструкция по медицинскому применению Сорбифер Дурулес ® (железа II сульфат + [Аскорбиновая кислота] https://grls.minzdrav.gov.ru/
- Учебник частной патологии и терапии внутренних болезней / Э.М.Гельштейн, В.Ф.Зеленин, изд. 3-е, М.: Медгиз, 1947
- DeMaeyer, E. M, and Joint WHO/UNICEF Nutrition Support Programme. Preventing and Controlling Iron Deficiency Anaemia through Primary Health Care : A Guide for Health Administrators and Programme Managers. Geneva: World Health Organization, 1989. Print.
- Приложение к журналу «Терапия» Под ред. акад. Мартынова А.И. Гематология под ред. д.м.н. Птушкина В.В., июнь 2021
Свежие комментарии